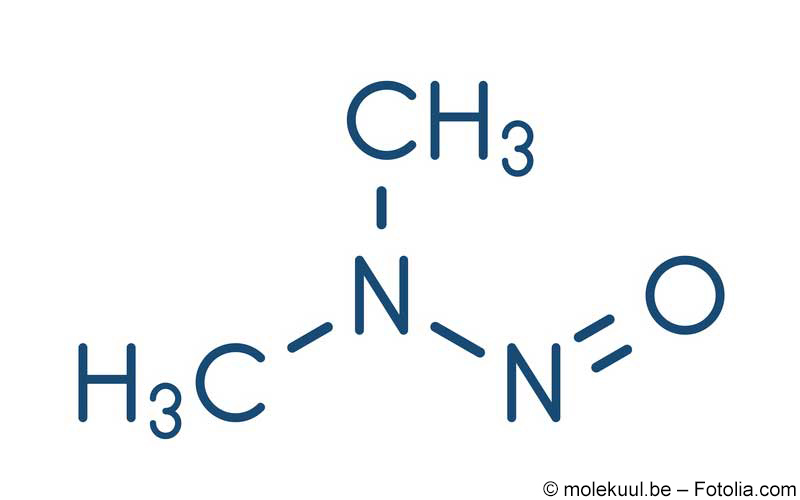
Bisher war Nitrosamin (NDMA) nur als Verunreinigung in Arzneimitteln nachgewiesen worden, die Valsartan, Candesartan, Irbesartan, Losartan und Olmesartan enthielten. Die in den Sartanen mit Tretrazolring gefundenen Verunreinigungen mit NDMA und NDEA stammten aus den Syntheseprozessen, aber auch aus potenziell verunreinigten Rohmaterialien. Deshalb wurden im April 2019 Bedingungen für das Inverkehrbringen von diesen Sartanen veröffentlicht. Wir berichteten hierzu.
Die U.S. Food and Drug Administration (FDA) nutzte dieses Wissen über die Hauptursachen, um weitere Stoffe auf mögliche Verunreinigungen zu prüfen. Wie die FDA mitteilt, teste man Proben anderer Wirkstoffe mit ähnlichem Herstellungsprozess, allerdings gibt es noch keine Informationen, welche Wirkstoffe konkret gemeint sind.
Wie die FDA bekanntgab, ist die gefundene Nitrosamin-Verunreinigung in Präparaten mit dem H2-Rezeptor-Antagonisten Ranitidin allerdings gering.
Umstellung auf andere Arzneimittel?
Die European Medicines Agency (EMA) und die FDA fordern die Patienten nicht auf, die Einnahme von Ranitidin einzustellen. Dennoch können Patienten, die verschreibungspflichtiges Ranitidin einnehmen und die Einnahme beenden möchten, mit ihrem Arzt über andere Behandlungsmöglichkeiten sprechen. Patienten, die freiverkäufliches Ranitidin einnehmen, können nach Rücksprache mit ihrem Apotheker auf Alternativen umstellen.
Leitlinien zur Vermeidung von Nitrosaminverunreinigungen sind in Arbeit
Die EMA wird nun die Verunreinigungen von Ranitidinen weiter prüfen und arbeitet außerdem an Leitlinien zur Vermeidung von Nitrosaminverunreinigungen in Humanarzneimitteln, die chemisch synthetisierte Wirkstoffe enthalten.














