Die Abgabe des bislang nicht zugelassenen Arzneimittels soll über die Apotheken erfolgen. Um eine qualitätsgesicherte Beratung und Abgabe von Lagevrio zu gewährleisten, wurde von der Arzneimittelkommission der Deutschen Apotheker (AMK) eine Beratungs- und Dokumentationsleitfaden zur Verfügung gestellt.
Bei der Abgabe muss beachtet werden, dass die vom Bundesministerium für Gesundheit (BMG) beschafften Arzneimittelpackungen Lagevrio für Großbritannien produziert wurden und deshalb sämtliche Angaben bis auf weiteres in englischer Sprache vorliegen. Hier eine nicht-zertifizierte Übersetzung der Gebrauchsinformation mit Textstand November 2021 zu Lagevrio 200 mg hard capsules.
Was ist Lagevrio und wofür wird es angewendet?
Lagevrio (Molnupiravir) befindet sich seit dem 25. Oktober 2021 im Rolling-Review-Verfahren der EMA. In Großbritannien wurde das Corona-Medikament bereits Anfang November 2021 zugelassen. Mitte November 2021 hatte der Ausschuss für Humanarzneimittel (CHMP) eine Empfehlung zur Anwendung von Molnupiravir vorgelegt, wonach das Medikament zur Behandlung von erwachsenen Risikopatienten mit COVID-19 angewendet werden kann, wenn diese keinen zusätzlichen Sauerstoff benötigen.
Wichtig ist, dass die Anwendung von Lagevrio so schnell wie möglich nach der Diagnose und innerhalb von fünf Tagen nach Symptombeginn erfolgen muss.
Lagevrio wird während der Schwangerschaft und bei Frauen, die keine wirksame Empfängnisverhütung anwenden, nicht empfohlen. Der Ausschuss gibt an, dass Frauen, während der Behandlung und für vier Tage nach der letzten Dosis von Lagevrio eine wirksame Verhütungsmethode anwenden müssen. Auch sollte das Stillen während der Behandlung und für vier Tage nach der Behandlung unterbrochen werden.
Wie wird Lagevrio angewendet?
Lagevrio soll innerhalb von fünf Tagen nach Symptombeginn für fünf Tage zweimal täglich eingenommen werden.
Dosierung
Die empfohlene Dosierung beträgt 800 mg Molnupiravir (vier 200 mg Kapseln) alle 12 Stunden über 5 Tage.
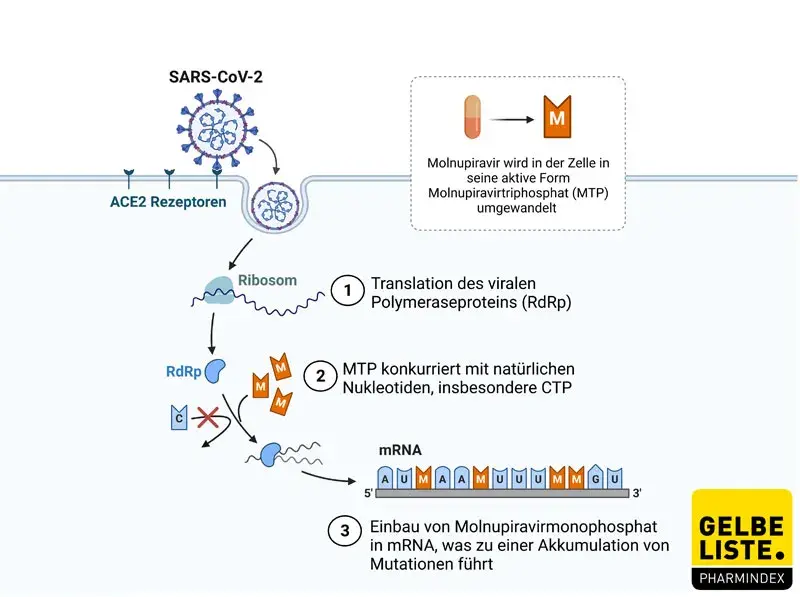
Wie wirkt Lagevrio?
Das Prodrug Molnupiravir wird im Plasma zu β-D-N4-Hydroxycytidin (NHC) gespalten und anschließend von wirtseigenen Kinasen zum aktiven Molnupiravir-5‘-Triphosphat (MTP) phosphoryliert. MTP ist ein Nukleotidanalogon von Cytidintriphosphat (CTP) und in seiner tautomeren Form unter anderem auch von Uridintriphosphat (UTP). Somit konkurriert MTP als Substrat der (SARS-CoV-2-)RNA-abhängigen RNA Polymerase vorwiegend mit CTP aber auch mit UTP und führt zu C zu U Mutationen, sowie G zu A Mutationen. Die Replikation des viralen Genoms wird dabei nicht inhibiert. Vielmehr bedingt eine steigende Mutationslast das Ende der Virusreplikation und unterbricht die Generierung weiterer Viruspartikel. Klinisch wird infolgedessen die Viruslast gesenkt.