Was ist Enspryng und wofür wird es angewendet?
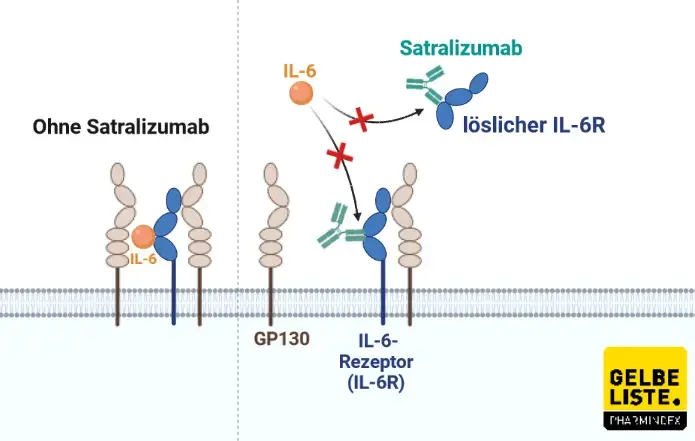
Enspryng (Satralizumab) von Roche ist ein humanisierter monoklonaler Antikörper, der gegen den Interleukin-6 (IL-6)-Rezeptor gerichtet ist und den IL-6-Signalweg unterbricht, der beim Entzündungsprozess von NMOSD-Patienten eine entscheidende Rolle spielt.
Das Arzneimittel wird als Monotherapie oder in Kombination mit einer immunsuppressiven Therapie zur Behandlung von Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) bei Erwachsenen und Jugendlichen ab 12 Jahren angewendet, die anti-Aquaporin-4-IgG-(AQP4-IgG-)seropositiv sind.
In Kombination kann Enspryng zusammen mit oralen Kortikosteroiden, Azathioprin oder Mycophenolatmofetil angewendet werden.
Über NMOSD
NMOSD sind eine Gruppe seltener, chronisch entzündlicher Autoimmunerkrankungen des zentralen Nervensystems, die zu schweren Schäden vorwiegend am Sehnerv und am Rückenmark und zu irreversiblen kumulativen Behinderungen wie Blindheit und Gehunfähigkeit führen können. NMOSD werden häufig mit pathogenen Antikörpern (AQP4-IgG) assoziiert, die gegen einen spezifischen Zelltyp, die sogenannten Astrozyten, gerichtet sind und diesen schädigen. Die Folge sind entzündliche Läsionen der Sehnerven, des Rückenmarks und des Gehirns. AQP4-IgG-Antikörper sind im Blutserum von rund drei Viertel der NMOSD-Patienten nachweisbar.
Obwohl die meisten NMOSD-Fälle mittels eines Diagnosetests bestätigt werden können, erhalten Menschen, die mit der Erkrankung leben, immer noch häufig die Fehldiagnose Multiple Sklerose. Dies kann zu Verzögerungen bei der korrekten Diagnose führen und eine Behandlung mit Medikamenten zur Folge haben, die den Krankheitsverlauf verschlechtern. Ursachen für die Fehldiagnose sind die sich überschneidenden Merkmale dieser Erkrankungen, darunter die höhere Prävalenz bei Frauen, die ähnlichen Symptome und die Tatsache, dass diese Krankheiten durch einen schubförmigen Verlauf gekennzeichnet sind.
Wie wird Enspryng angewendet?
Enspryng ist als Injektionslösung in einer Fertigspritze erhältlich. Empfohlene Injektionsstellen sind Bauchdecke und Oberschenkel. Die Injektionsstelle ist zu wechseln und es darf niemals in Muttermale, Narben, Hämatome oder Bereiche mit empfindlicher, geröteter, verhärteter oder verletzter Haut injiziert werden.
Dosierung
Initialdosis
Die empfohlene Initialdosis für die ersten drei Anwendungen beträgt 120 mg als subkutane (s.c.) Injektion alle zwei Wochen (erste Dosis in Woche 0, zweite Dosis in Woche 2 und dritte Dosis in Woche 4).
Erhaltungsdosis
Die empfohlene Erhaltungsdosis beträgt 120 mg als s.c. Injektion alle vier Wochen.
Wie wirkt Enspryng?
Der rekombinante humanisierte monoklonale Immunglobulin-G2(IgG2)-Antikörper Satralizumab bindet an den löslichen und membrangebundenen humanen IL-6-Rezeptor wodurch eine IL-6 nachgeschaltete Signalgebung durch diese Rezeptoren gehemmt wird. Bei Patienten mit NMO (Neuromyelitis-Optica) und NMOSD ist in den Phasen der Krankheitsaktivität die IL-6-Konzentration in der Zerebrospinalflüssigkeit und im Serum erhöht.
IL-6-Funktionen sind an der Pathogenese von NMO und NMOSD beteiligt, darunter an:
- der B-Zell-Aktivierung
- der Differenzierung von B-Lymphozyten zu Plasmablasten
- der Produktion von pathologischen Autoantikörpern (z. B. gegen AQP4, einem Wasserkanalprotein, das hauptsächlich durch Astrozyten im zentralen Nervensystem exprimiert wird)
- der Th17-Zell-Aktivierung und -Differenzierung
- der Inhibierung von regulatorischen T-Zellen
- Veränderungen der Permeabilität der Blut-Hirn-Schranke
Gegenanzeigen
Enspryng darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter der Anwendung von Enspryng gemeldeten Nebenwirkungen waren:
- Kopfschmerzen (19,2%)
- Arthralgie (13,5%)
- verringerte Leukozytenzahl (13,5%)
- Hyperlipidämie (13,5%)
- injektionsbedingte Reaktionen (12,5%)
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Doch wurde in pharmakokinetischen Populationsanalysen kein Effekt von Azathioprin, oralen Corticosteroiden oder Mycophenolatmofetil auf die Satralizumab-Clearance festgestellt.
CYP-Interaktionen
Sowohl In-vitro- als auch In-vivo-Studien haben gezeigt, dass die Expression spezifischer hepatischer CYP450-Enzyme (CYP1A2, CYP2C9, CYP2C19 und CYP3A4) durch Zytokine wie IL-6 supprimiert wird.
Deshalb ist bei Beginn oder Absetzen der Behandlung mit Satralizumab Vorsicht bei Patienten geboten, die bereits CYP450 3A4-, -1A2-, -2C9- oder -2C19-Substrate erhalten, insbesondere Substrate mit engem therapeutischem Fenster (wie Warfarin, Carbamazepin, Phenytoin und Theophyllin).
Dosisanpassungen sind bei Bedarf vorzunehmen.
CAVE: Lange Halbwertszeit
Aufgrund der verlängerten terminalen Halbwertszeit von Satralizumab kann die Wirkung von Satralizumab mehrere Wochen nach Behandlungsende anhalten
Studienlage
Die Zulassung von Enspryng basiert auf den Ergebnissen der zwei randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien: SAkuraStar (BN40900)1 und SAkuraSky (BN40898)2) sowie auf der laufenden Langzeit-Erweiterungsstudie bei einer breiten Patientenpopulation.
SAkuraStar und SAkuraSky
Ziel von SAkuraStar und SAkuraSky ist es, die Wirksamkeit und Sicherheit von Enspryng im Vergleich zu Placebo als Monotherapie (SAkuraStar n=95) und als Zusatztherapie (SAkuraSky, n=83) zur bestehenden Behandlung mit Immunsuppressiva, wie zum Beispiel Azathioprin, Mycophenolatmofetil oder oralen Kortikosteroiden, zu untersuchen. Bei den für die Studien geeigneten NMOSD-Patienten ist in dem Jahr vor dem Studienscreening mindestens ein Schub aufgetreten.
Ergebnisse
Beide Studien erreichten ihre primären Endpunkte − die Verlängerung der Zeit bis zum ersten durch das Protokoll festgelegten Schub und die Reduktion des Schubrisikos. Das Arzneimittel zeigte eine verlässliche Wirksamkeit und wies ein ähnliches Sicherheitsprofil wie Placebo auf.
Insgesamt war der Anteil der Patienten, bei denen Nebenwirkungen oder schwerwiegende Nebenwirkungen, einschließlich schwerwiegender Infektionen, auftraten, bei den mit Satralizumab oder Placebo behandelten Patienten vergleichbar.
Das Sicherheitsprofil der Monotherapie mit Satralizumab war mit jenem vergleichbar, das bei der Anwendung von Satralizumab in Kombination mit immunsuppressiver Therapie beobachtet wurde.
Insgesamt wurde Enspryng in den Phase-III-Studien von den NMOSD-Patienten gut vertragen. Es wurden keine Todesfälle oder anaphylaktischen Reaktionen beobachtet.
Als Monotherapie zeigte Enspryng bei AQP4-IgG-seropositiven Patienten:
- eine Reduktion des Schubrisikos um 74% gegenüber Placebo (HR: 0,26; 95%-KI: 0,11, 0,63; p=0,0014)
- 77% der Patienten bleiben mit Enspryng schubfrei gegenüber 41% in der Placebo-Gruppe und zeigen während des Behandlungszeitraums von 96 Wochen eine anhaltende Wirksamkeit.
Als Zusatztherapie zeigte Enspryng bei AQP4-IgG-seropositiven Patienten:
- eine Reduktion des Schubrisikos um 79% gegenüber Placebo (HR: 0,21; 95%-KI: 0,06, 0,75; p=0,0086)
- 92% der Patienten bleiben mit Enspryng schubfrei gegenüber 53% in der Placebo-Gruppe und belegen während des Behandlungszeitraums von 96 Wochen eine anhaltende Wirksamkeit.