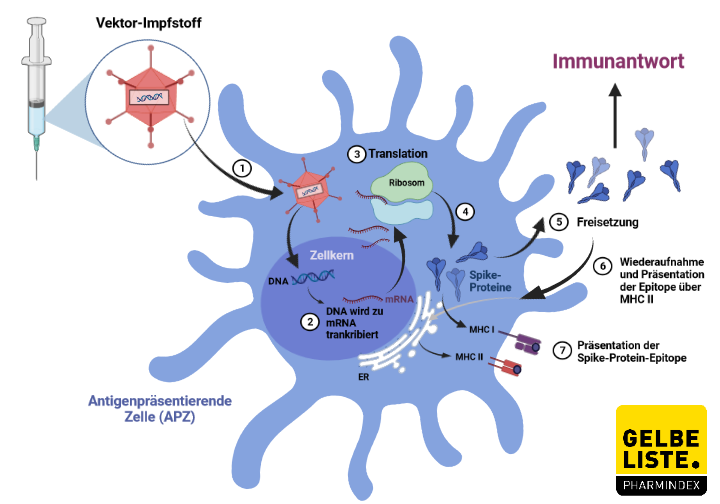
Was ist AZD1222 und wofür wird es angewendet?
Der replikationsdefiziente Schimpansen-Adenovirus-Vektor AZD1222 von AstraZeneca ist unter dem Namen Vaxzevria zur aktiven Immunisierung von Personen ab 18 Jahren zur Vorbeugung der Coronavirus-Krankheit 2019 (COVID-19) indiziert. Aufgrund neuer Daten empfahl die STIKO seit dem 4. März 2021 den Corona-Impfstoff AZD1222 von AstraZeneca auch für über 65-Jährige. Auf Basis der verfügbaren Daten zu den kürzlich gemeldeten sehr schweren thromboembolischen Nebenwirkungen 4 bis 16 Tage nach der Impfung, die überwiegend bei Personen im Alter unter 60 Jahren auftraten, und unter Hinzuziehung externer Experten hat die Ständige Impfkommission (STIKO) am 30. März 2021 mehrheitlich entschieden, den Corona-Impfstoff AZD1222 von AstraZeneca nur noch für Personen ab einem Alter von 60 Jahren zu empfehlen.
Zuvor sollte aus Sicht der STIKO der Corona-Impfstoff AZD1222 nur bei 18- bis 64-Jährigen angewendet werden. Die Wirksamkeit bei Älteren war zu diesem Zeitpunkt nicht ausreichend belegt. Abgesehen von dieser Einschränkung wurde der Impfstoff jedoch als gleichermaßen geeignet wie die bereits zugelassenen Corona-Impfstoffe angesehen. Auch die EMA räumte ein, dass bei älteren Teilnehmern (über 55 Jahre) zu diesem Zeitpunkt noch nicht genügend Ergebnisse vorlägen, um eine Aussage darüber zu treffen, wie gut der Impfstoff in dieser Gruppe wirke. Da jedoch ein Schutz erwartet werde, weil auch in dieser Altersgruppe eine Immunantwort beobachtet wurde, waren die wissenschaftlichen Experten der EMA der Ansicht, dass der Impfstoff bei älteren Erwachsenen angewendet werden kann.
Hinweise der STIKO
- Tritt nach Verabreichung der 1. Impfstoffdosis eine labordiagnostisch gesicherte (positive PCR) SARS-CoV-2-Infektion auf, soll die Verabreichung der 2. Impfstoffdosis etwa 6 Monate nach Genesung bzw. Diagnosestellung erfolgen
- Im Allgemeinen wird eine Nachbeobachtungszeit nach der COVID-19-Impfung von mindestens 15 Minuten empfohlen. Längere Nachbeobachtungszeiten von bis zu 30 Minuten sollten vorsichtshalber bei bestimmten Risikopersonen eingehalten werden, z. B. bei Personen mit Gerinnungshemmung, stärkeren oder anaphylaktischen Reaktionen auf Impfungen in der Anamnese.
Alle Updates zu Lagerung, Transport, Herstellung, Haltbarkeit etc. im Vergleich zu den anderen zugelassenen Corona-Impfstoffen finden Sie hier.
Wie wird AZD1222 angewendet?
AZD1222 wird intramuskulär im Abstand von 4 bis maximal 12 Wochen (28 bis 84 Tage) in den Deltamuskel verabreicht. Es wird empfohlen, dass Personen, die eine erste Dosis AZD1222 erhalten haben, die zweite Dosis vom gleichen Hersteller bekommen. Die Impfung ist strikt intramuskulär (i.m.) und keinesfalls intradermal, subkutan oder intravaskulär zu verabreichen. Der Impfstoff ist applikationsfertig und wird vor der Applikation nicht verdünnt.
Lagerung und Haltbarkeit
- Ungeöffnet: 6 Monate bei 2°C bis 8°C
- Nach dem ersten Gebrauch soll der Impfstoff so bald wie möglich und innerhalb von 6 Stunden verabreicht werden
- Der Impfstoff kann während des Gebrauchs zwischen 2°C und 25°C gelagert werden
Dosierung
Das Impfregime besteht aus zwei Dosen mit 5 x 1010 Viruspartikeln entsprechend 0,5 ml der Vakzine im Abstand von mindestens 4 bis maximal 12 Wochen (28 bis 84 Tage). Die STIKO empfiehlt einen Abstand von 12 Wochen.
Wie wirkt AZD1222?
AZD1222 besteht aus einem replikationsdefizienten Schimpansen-Virusvektor, der auf einer geschwächten Version eines Erkältungsvirus (Adenovirus) basiert, das Infektionen bei Schimpansen verursacht und die virale DNA des Spike-Proteins des SARS-CoV-2-Virus in den Körper eingeschleust. Nach der Impfung wird das Oberflächen-Spike-Protein produziert, welches das Immunsystem darauf vorbereitet, das SARS-CoV-2-Virus anzugreifen, wenn es später den Körper infiziert.
Gegenanzeigen
AZD1222 darf nicht appliziert werden:
- bei Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe.
- wenn nach vorheriger Impfung mit diesem Impfstoff ein Thrombose-mit-Thrombozytopenie-Syndrom (TTS) aufgetreten ist.
- bei Personen, die schon einmal ein Kapillarlecksyndrom erlitten haben.
Hilfsstoffe
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen in klinischen Studien waren:
- Empfindlichkeit an der Injektionsstelle (>60%)
- Schmerzen an der Injektionsstelle, Kopfschmerzen, Müdigkeit (>50%)
- Myalgie, Unwohlsein (>40%)
- Pyrexie, Schüttelfrost (>30%)
- Arthralgie, Übelkeit (>20%)
Die meisten Nebenwirkungen waren von leichter bis mittelschwerer Ausprägung und verschwanden normalerweise innerhalb weniger Tage nach der Impfung. Im Vergleich zur ersten Dosis waren die gemeldeten Nebenwirkungen nach der zweiten Dosis milder und weniger häufig.
Bei älteren Probanden (≥65 Jahre) waren Nebenwirkungen im Allgemeinen milder und seltener.
Sinusvenenthrombosen
Zahlreiche Staaten hatten im März 2021 das Verimpfen von AZD1222 gestoppt, nachdem mehrere Fälle von Sinusvenenthrombosen in zeitlichem Zusammenhang mit der Impfung gemeldet wurden. Auch Bundesgesundheitsminister Jens Spahn folgte am 15. März 2021 den Empfehlungen des Paul-Ehrlich-Instituts (PEI) und setzte Verimpfungen der AstraZeneca Vakzine in Deutschland offiziell aus. Die EMA empfahl daraufhin in einer Stellungnahme, die Impfungen gegen das Coronavirus mit dem Impfstoff von AstraZeneca fortsetzen. Es folgte ein Rote-Hand-Brief.
Idiopathische thrombozytopenische Purpura (ITP)/Thrombozytopenie
Im Zusammenhang mit der Impfung mit Vaxzevria wurden Fälle einer ITP mit und ohne Blutungen berichtet, darunter auch vereinzelte Fälle mit fulminanten Hirnblutungen. Thrombozytopenie ist als Nebenwirkung in der Produktinformation genannt.
Guillain-Barré-Syndrom
Es sind mehr Fälle eines Guillain-Barré-Syndroms (GBS) nach Vaxzevria gemeldet worden, als aufgrund der Anzahl geimpfter Personen zufällig erwartet wurde. Ob es sich um ein neues Risikosignal handeln könnte, wird weiter vom Paul-Ehrlich-Institut untersucht.
Kapillarlecksyndrom (Capillary-Leak-Syndrom, CLS)
- Es wurden sehr seltene Fälle des Kapillarlecksyndroms in den ersten Tagen nach der Impfung mit Vaxzevria berichtet. In einigen Fällen zeigte sich eine Vorgeschichte von CLS in der Anamnese. Es wurde ein Fall mit tödlichem Ausgang berichtet.
- Vaxzevria ist jetzt bei Personen kontraindiziert, die eine positive Anamnese von CLS haben (siehe Rote-Hand-Brief)
- Das CLS ist durch akute Ödembildung gekennzeichnet, die hauptsächlich die Gliedmaßen betrifft. Gleichzeitig treten Hypotonie, Hämokonzentration und Hypoalbuminämie auf. Patienten mit einer akuten CLS-Episode nach der Impfung benötigen eine sofortige Diagnosestellung und Behandlung. Eine intensivmedizinische unterstützende Therapie ist in der Regel angezeigt.
Den vollständigen Sicherheitsbericht des Paul-Ehrlich-Instituts vom 27.12.2020 bis 30.06.2021 finden Sie hier.
Wechselwirkungen
- Es wurden keine Interaktionsstudien durchgeführt.
- Die gleichzeitige Anwendung von AZD1222 mit anderen Impfstoffen wurde nicht untersucht.
- Die STIKO rät, dass zu anderen planbaren Impfungen ein Mindestabstand eingehalten wird: 14 Tage vor Beginn und 14 Tage nach Ende der Impfserie.
Studienlage
COV001
COV001 ist eine verblindete, multizentrische, randomisierte, kontrollierte Studie der Phase I/II zur Beurteilung der Sicherheit, Immunogenität und Wirksamkeit von AZD1222 bei 1.077 gesunden Erwachsenen in fünf Prüfzentren in Grossbritannien. Die Teilnehmer im Alter zwischen 18 und 55 Jahren erhalten nach dem Zufallsprinzip entweder eine oder zwei intramuskuläre Dosen AZD1222 mit 5x1010 Viruspartikeln oder ein Vergleichspräparat, den Meningokokken-Impfstoff MenACWY. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Jede Woche wird ein PCR-Test auf COVID-19 durchgeführt. Dieser wird 3 bis 5 Tage nach Auftreten der Symptome wiederholt, wenn die erste Probe negativ ist, und 7 Tage nach einem positiven PCR-Test.
COV002
COV002 ist eine einfach verblindete, multizentrische, randomisierte, kontrollierte Phase II/III-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 12.390 Studienteilnehmern in Grossbritannien. Die bisherigen Studienteilnehmer sind 18 Jahre oder älter, gesund oder haben medizinisch stabile chronische Erkrankungen und ein erhöhtes Risiko für eine Exposition gegenüber SARS-CoV-2. Die Teilnehmer erhielten eine oder zwei intramuskuläre Dosen einer halben Dosis (~2,5x1010 Viruspartikel) oder einer vollen Dosis (~5x1010 Viruspartikel) AZD1222 oder des Vergleichsimpfstoffs MenACWY gegen Meningokokken. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und es wrden klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Verdachtsfälle mit kompatiblen Symptomen werden zur virologischen Bestätigung von COVID-19 mittels PCR getestet. Darüber hinaus werden wöchentliche Abstriche zum Nachweis von Infektionen und zur Beurteilung der Wirksamkeit des Impfstoffs gegen Infektionen durchgeführt.
COV003
COV003 ist eine einfach verblindete, multizentrische, randomisierte, kontrollierte Phase-III-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 10.300 Teilnehmern in Brasilien. Die bisherigen Studienteilnehmer sind 18 Jahre oder älter, gesund oder haben medizinisch stabile chronische Erkrankungen und ein erhöhtes Risiko für eine Exposition gegenüber dem Coronavirus SARS-CoV-2. Die Teilnehmer erhalten nach dem Zufallsprinzip entweder zwei intramuskuläre Dosen einer vollen Dosis (~5x1010 Viruspartikel) AZD1222 oder eines Vergleichsimpfstoffs, des Meningokokken-Impfstoffs MenACWY, als erste Dosis und ein Kochsalz-Placebo als zweite Dosis. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Verdachtsfälle mit kompatiblen Symptomen werden zur virologischen Bestätigung von COVID-19 mittels PCR getestet.
COV005
COV005 ist eine verblindete, multizentrische, randomisierte, kontrollierte Phase I/II-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Immunogenität von AZD1222 bei 2.070 Studienteilnehmern in Südafrika. Die Studienteilnehmer im Alter zwischen 18 und 65 Jahren, mit oder ohne HIV, erhalten nach dem Zufallsprinzip entweder zwei intramuskuläre Dosen AZD1222 mit 5–7,5x1010 Viruspartikeln oder ein Kochsalz-Placebo. Den Studienteilnehmern wird mehrmals bis zu einem Jahr nach der Impfung Blut abgenommen und klinische Beurteilungen zur Sicherheit sowie zur Immunogenität durchgeführt. Regelmässige PCR-Tests auf COVID-19 werden bis zu einem Jahr nach der Impfung vorgenommen.
Zulassungsrelevante Ergebnisse
Eine Zwischenanalyse der klinischen Studien mit AZD1222 umfasste Daten aus der Phase-II/III-Studie COV002 (NCT04400838) in Großbritannien und der Phase-III-Studie COV003 (NCT04536051) in Brasilien. Insgesamt wurde die Wirksamkeit sowie Sicherheit an 23.000 Teilnehmer nach
- zwei Dosen einer halben Dosis (2,5x1010 Viruspartikel) und später einer vollen Dosis (5x1010 Viruspartikel) oder
- zwei volle Dosen AZD1222
gegenüber eines Vergleichs-Meningokokken-Konjugat-Impfstoffs namens MenACWY oder Kochsalzlösung evaluiert.
Wirksamkeit
- In der Zwischenanalyse wurden insgesamt 131 COVID-19-Fälle bestätigt. Wurde AZD1222 mit halbierter Dosis (n=2.741) gefolgt von einer vollen Dosis im Abstand von mindestens einem Monat verabreicht, zeigte sich eine Impfwirksamkeit von 90%.
- Wurden zwei volle Dosen im Abstand von mindestens einem Monat appliziert (n=8.895) zeigte sich eine Wirksamkeit von 62%.
- Die kombinierte Analyse beider Dosierungsschemata (n=11.636) ergab eine durchschnittliche Wirksamkeit von 70%.
- Alle Ergebnisse waren statistisch signifikant (p=0,0001).
- Nach Daten aus The Lancet wirkt der Impfstoff bei verschiedenen Altersgruppen einschließlich älterer Patienten.
Im Vergleich mit den anderen bereits zugelassenen Corona-Impfstoffen, weist AZD eine verhältnismäßig geringe Wirksamkeit auf. Zu beachten ist hierbei allerdings, dass aufgrund der Datenlage noch keine abschließenden Bewertungen der Wirksamkeit getroffen werden können und dass es für Vektorimpfstoffe bekannt ist, dass diese zum Teil erst nach längerer Zeit ihre volle Wirksamkeit entfalten (Nachreifen der Immunität).
Wirksamkeit bei Coronavirus-Mutantion E484K
Im Labor ist messbar, dass es zu einem Absinken der Neutralisationseffizienz durch AZD1222 kommt. Dies bedeutet alledings nicht zwangsläufig, dass die T-Zell-Immunität oder die Schutzwirkung gegen schwere Verläufe oder Anzahl der Krankenhausaufnahmen schlechter wird.
Wirksamkeitsdaten bei Älteren
In der Phase-II/III-Studie (COV002) mit 560 Probanden wurde untersucht, wie immunogen und sicher der Impfstoff in drei Altersgruppen (18 bis 55 Jahre, 56 bis 69 Jahre, über 70 Jahre) ist: 160 Probanden waren zwischen 18 und 55 Jahre alt, weitere 160 Probanden waren zwischen 56 und 69 Jahre alt und 240 Probanden waren 70 Jahre und älter. Die Ergebnisse wurden im November im The Lancet veröffentlicht. Doch kann man schon hier festhalten, dass es sich um eine zu geringe Probandenanzahl für eine Wirksamkeitsanalyse handelt. Die Studie zeigte, dass der Impfstoff bei älteren Probanden besser verträglich war als bei jüngeren und dass nach einer Boost-Dosis über alle Altersgruppen hinweg eine ähnliche Immunogenität erzielt wurde. Es wurde jedoch angemerkt, dass für die Bewertung der Wirksamkeit in allen Altersgruppen und Personen mit Komorbiditäten weitere Beurteilungen erforderlich seien.
Am 8. Dezember 2020 folgte daraufhin eine weitere Publikation in The Lancet, welche auf die Ergebnisse der Studien (NCT04324606, NCT04400838, und NCT04444674) einging. Dort hieß es, dass in diesen Wirksamkeitsstudien wegen geringer Fallzahlen noch wenig Daten zur Wirksamkeit bei älteren Menschen vorliegen. Gerade einmal 8 Prozent der Probanden waren zwischen 56 und 69 Jahren und nur 3 bis 4 Prozent über 70 Jahre. Im MHRA-Dokument selbst heißt es, dass zur Wirksamkeit bei Personen ab 65 Jahren „nur begrenzte Informationen vorliegen, obwohl nichts auf einen mangelnden Schutz hindeutet."
Panne bei den Dosierungen und was daraus gemacht wurde
Alle vier klinischen Studien (COV001, COV002, COV003 und COV005) wurden ursprünglich als Einzeldosis-Schema geplant; im Juli 2020 wurde dies allerdings in ein Zwei-Dosis-Schema geändert. Der Boost sollte zum frühestmöglichen Zeitpunkt (28 Tage nach der Erstdosis) verabreicht werden. Die Auswertung zeigte, dass Probanden, die eine niedrigere Prime-Dosis (halbe Dosis) und eine Standard-Boost-Dosis (LDSD) bekommen hatten, nach der Boosterung höhere Antikörpertiter und einen besseren Schutz aufwiesen als diejenigen, die zwei Standarddosen (SDSD) erhielten.
Trotzdem wurde der Impfstoff für die Verwendung der höheren Dosierungen zugelassen. Das ergibt im ersten Moment nicht wirklich Sinn.
Im Zulassungsdokument findet man die Erklärung
In der SDSD-Gruppe wurde ein Trend beobachtet, dass längere Dosisintervalle mit höheren Reaktionen verbunden waren. Beim Vergleich von SDSD- und LDSD-Gruppen mit demselben Dosisintervall sei die Immunantwort nach der zweiten Dosis ähnlich. Es heißt weiter „Angesichts der Tatsache, dass das mittlere Dosisintervall in der LDSD-Gruppe 12 Wochen betrug, verglichen mit 5 Wochen in der SDSD-Gruppe in Brasilien und 10 Wochen in der SDSD-Gruppe in Großbritannien, deuten diese Daten darauf hin, dass die in der LDSD-Gruppe hervorgerufenen höheren Immunogenitätsniveaus stärker vom Intervall als von der Dosisstufe beeinflusst werden.“
Eine umfangreiche Vergleichsseite der zugelassenen Impfstoffe finden Sie hier.