Das Präparat befand sich seit dem 24. Februar 2021 im Rolling-Review-Verfahren der EMA. Bereits am 26. März 2021 hatte der CHMP ein wissenschaftliches Gutachten über den Antikörper vorgelegt, in dem der Ausschuss zu dem Schluss gelangte, dass Regdanvimab zur Behandlung von bestätigtem COVID-19 bei Patienten angewendet werden kann, die keinen zusätzlichen Sauerstoff benötigen und bei denen ein hohes Risiko für einen schweren COVID-19-Verlauf besteht.
Was ist Regkirona und wofür wird es angewendet?
Bei Regkirona (Regdanvimab, CT-P59) des südkoreanischen Pharmaunternehmens Celltrion handelt es sich um ein Antikörperpräparat, das indiziert ist zur Behandlung von bestätigtem COVID-19 bei erwachsenen Risikopatienten, die keine zusätzliche Sauerstofftherapie aufgrund von COVID-19 benötigen.
Die Behandlung mit Regkirona sollte so bald wie möglich nach der Diagnose eingeleitet werden, spätestens jedoch sieben Tage nach Auftreten der Symptome.
Zu den Risikofaktoren für einen schweren Verlauf zählen:
Wie wird Regkirona angewendet?
Regkirona ist zur intravenösen Anwendung bestimmt und wird über 90 Minuten verabreicht.
Dosierung
Die empfohlene Dosis von Regkirona beträgt 40 mg/kg Regdanvimab als einmalige intravenöse Infusion.
Wie wirkt Regkirona?
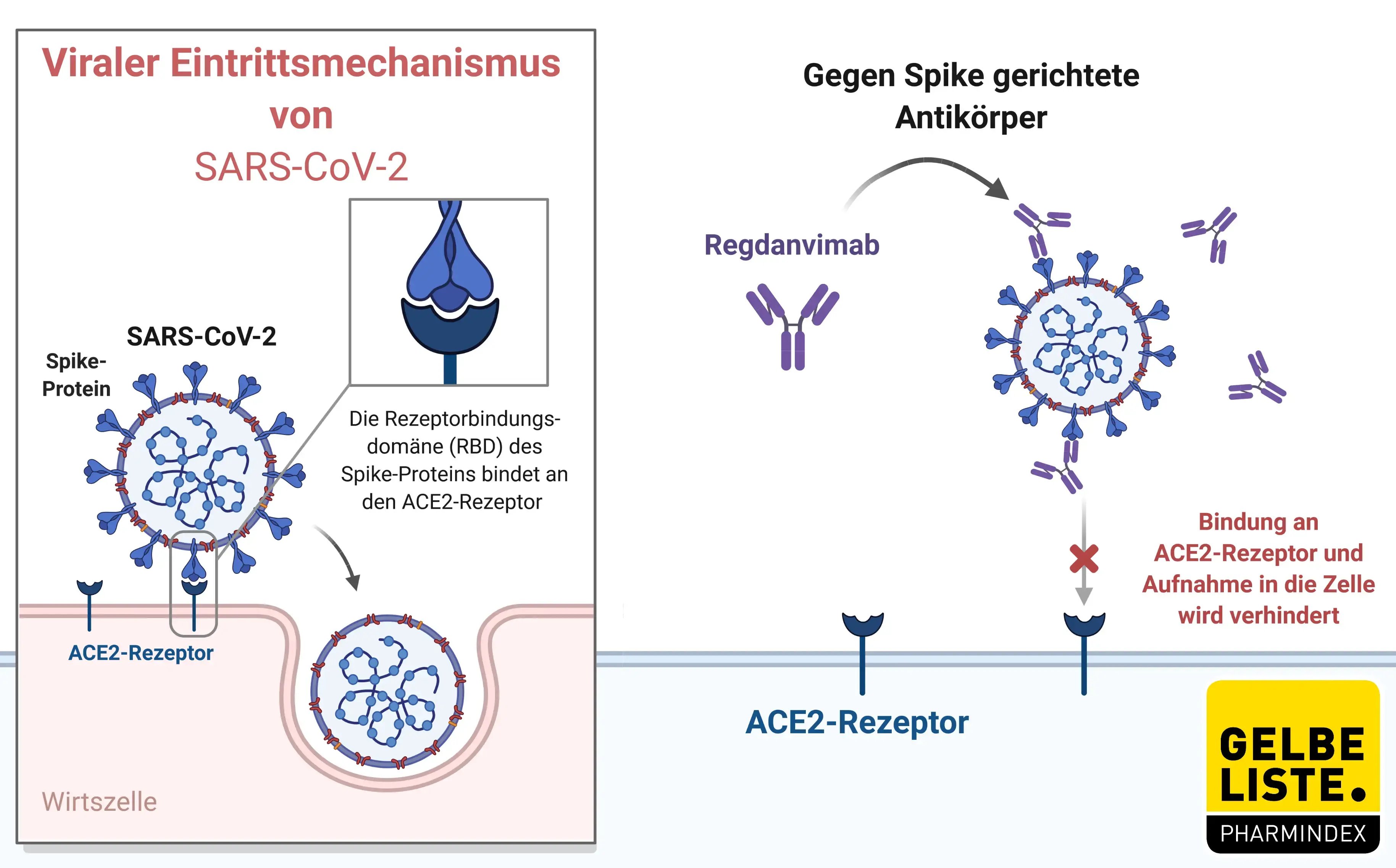
Regdanvimab ist ein rekombinanter humaner monoklonaler IgG1-Antikörper, der an die Rezeptorbindungsdomäne (RBD) des Spike-Proteins von SARS-CoV-2 bindet und so die Interaktion zwischen der SARS-CoV-2-RBD und dem zellulären ACE2-Rezeptor verhindert, wodurch der zelluläre Eintritt von SARS-CoV-2 verhindert wird.
Gegenanzeigen
Regkirona darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen Regdanvimab oder einen der sonstigen Bestandteile.
Nebenwirkungen
Die am häufigsten berichtete Nebenwirkung im Zusammenhang mit Regdanvimab bei leichtem bis mittelschwerem COVID-19 war Hypertriglyzeridämie (2,8%).
In der Studie CT-P59 3.2 Teil 1 wurden bei 0,5% der mit Regdanvimab behandelten Patienten nicht schwerwiegende infusionsbedingte Reaktionen beobachtet. Die berichteten Ereignisse von Dyspnoe waren leicht und Fieber mäßig ausgeprägt.
Wechselwirkungen
Da es sich bei Regkirona um einen monoklonalen Antikörper handelt, die bekannter Maßen nicht über die Niere ausgeschieden oder durch Cytochrom P450 Enzyme verstoffwechselt werden, ist es unwahrscheinlich, dass eine Kombination mit anderen Arzneimitteln, die über diese Wege metabolisiert oder eliminiert werden, zu Wechselwirkungen führt.
Eine Wechselwirkung mit COVID-19-Impfungen kann allerdings nicht ausgeschlossen werden, da es hierzu keine Untersuchungen gibt.
Studienlage
Das klinische Entwicklungsprogramm von Regkirona umfasst zwei Phase-I-Studien und eine Phase-II/III-Studie:
- Phase-I-Studie CT-P59 1.1 (NCT04525079) an gesunden Freiwilligen Dosisstufen: 10, 20, 40 und 80 mg/kg (n=6 pro Dosisgruppe). PK-Probenahme bis zum Tag 90 nach der Dosis.
- Phase-I-Studie CT-P59 1.2 (NCT04593641) an Patienten mit leichtem COVID-19 Dosisstufen: 20, 40 und 80 mg/kg (n=5 pro Dosisgruppe). Begrenzte Probenahme (bis Tag 14). Keine PK-Analyse.
- Phase-II/III-Studie CT-P59 3.2 (NCT04602000) an Patienten mit leichtem bis mittelschwerem COVID-19 Dosisspiegel: 40 mg/kg (n=29) und 80 mg/kg (n=32). PK-Probenahme bis Tag 28 nach Einnahme.
Ergebnisse
In der Phase-I-Studie (NCT04593641) bei Patienten mit leichter SARS-CoV-2-Infektion zeigte Regdanvimab eine dosisproportionale Pharmakokinetik über einen Dosisbereich von 20–80 mg/kg. Die mediane Zeit bis Cmax betrug 2,5 h; Regdanvimab blieb bis zu 14 Tage im Blut nachweisbar [6].
Daten der randomisierten, doppelblinden, placebokontrollierten klinischen Phase-II/III-Studie (NCT04602000) mit 1020 Patienten an Patienten mit COVID-19 konnten zeigen, dass Regkirona im Vergleich zu Placebo zu weniger Krankenhausaufenthalten, Sauerstofftherapie oder Tod führte. 3,1% der mit Regkirona behandelten Risikopatienten (14 von 446) mussten ins Krankenhaus eingeliefert werden und benötigten zusätzlichen Sauerstoff oder starben innerhalb von 28 Behandlungstagen im Vergleich zu 11,1% der Patienten unter Placebo (48 von 434).