Hintergrund
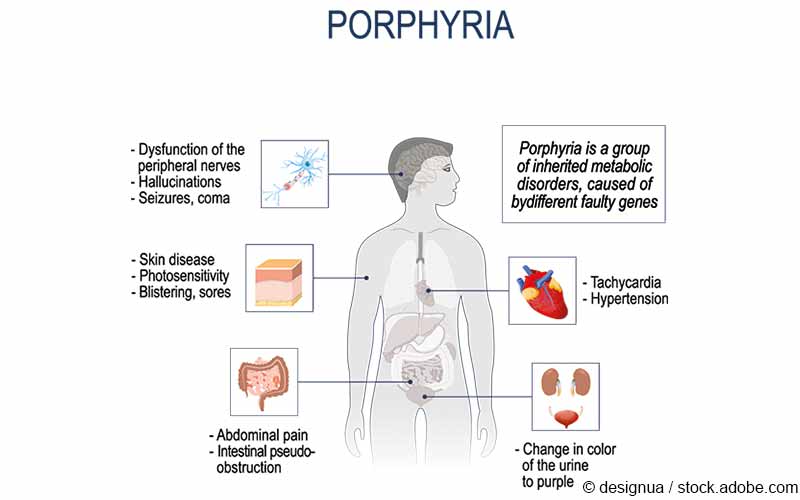
Bei der akuten hepatischen Porphyrie (AHP) handelt es sich um eine seltene genetische Erkrankung, bei der es zu einem Mangel eines der Enzyme der Häm-Biosynthese kommt. Da Häm neben einem Eisen-Ion aus einem aromatischen Porphyrin besteht, können bei einer gestörten Häm-Synthese vermehrt Porphyrine und ihre Vorstufen anfallen und sich in den Geweben ablagern. In der Folge kann es zu starken Bauchschmerzen, Erbrechen und Krampfanfällen kommen, die aufgrund der Möglichkeit eines Atemstillstandes während den Anfällen lebensbedrohlich sein können. Bei vielen Patienten treten auch chronische Symptome auf.
Nachdem im Februar der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) Givlaari der Firma Alnylam Netherlands B.V. zur Zulassung empfohlen hat, folgte nun die endgültige Zulassung durch die Europäische Kommission.
Bisher gab es für Patienten mit AHP keine zugelassene medikamentöse Therapie.
Was ist Givlaari und wofür wird es angewendet?
Givlaari ist ein Arzneimittel zur RNA-Interferenz und wird angewendet für die Behandlung einer AHP bei Erwachsenen und Jugendlichen ab 12 Jahren.
Wie wird Givlaari angewendet?
Givlaari ist zur subkutanen Anwendung bestimmt.
Dosierung
Die empfohlene Dosis von Givlaari beträgt 2,5 mg/kg einmal monatlich, verabreicht als subkutane Injektion. Die Dosierung richtet sich nach dem tatsächlichen Körpergewicht.
Wie wirkt Givlaari?
Der Wirkstoff Givosiran in Givlaari ist eine doppelsträngige, kleine interferierende Ribonukleinsäure (small interfering Ribonucleic Acid; siRNA), die einen Abbau von Aminolävulinsäure-Synthase-1(ALAS1)-mRNA in den Leberzellen durch RNA-Interferenz bewirkt. In der Folge kommt es zu einer Verringerung von induzierter ALAS1-mRNA in der Leber. Dies führt zu geringeren Blutspiegeln der neurotoxischen Zwischenprodukte Aminolävulinsäure (ALA) und Porphobilinogen (PBG), den wichtigsten kausalen Faktoren für Attacken und andere Erkrankungsmanifestationen der AHP.
Gegenanzeigen
Givlaari darf nicht angewendet werden bei bekannter schwerer Überempfindlichkeit (z. B. Anaphylaxie) gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Nebenwirkungen
Die am häufigsten aufgetretenen Nebenwirkungen bei Patienten, die mit Givosiran behandelt wurden, sind:
- Reaktionen an der Injektionsstelle (36%)
- Übelkeit (32,4%)
- Müdigkeit (22,5%)
Andere Nebenwirkungen, die bei mit Givosiran behandelten Patienten beobachtet wurden (≥ 10% häufiger als bei Placebo), sind:
- Transaminase-Erhöhungen
- Hautausschlag
- Abnahme der glomerulären Filtrationsrate
Wechselwirkungen
Givosiran führte zu einer leicht bis mäßig reduzierten Wirksamkeit bestimmter CYP450-Enzyme in der Leber. In der Folge erhöhte sich die Plasmaexposition von
Während der Anwendung von Givlaari ist deshalb Vorsicht geboten bei der Verwendung von Arzneimitteln, die Substrate von CYP1A2 oder CYP2D6 sind, da sich die therapeutische Wirkung dieser Arzneimittel erhöhen oder verlängern oder sich deren Nebenwirkungsprofil verändern kann.
Bei Anwendung von CYP1A2- oder CYP2D6-Substraten sollte eine Dosisreduktion gemäß der Fachinformation in Erwägung gezogen werden.
Studienlage
ENVISION
Die Genehmigung für das Inverkehrbringen von Givlaari basierte auf positiven Daten aus der Phase-3-Studie ENVISION, einer randomisierten, doppelblinden, placebokontrollierten, globalen, multizentrischen Studie. Ziel war die Bewertung der Wirksamkeit und Sicherheit von Givosiran bei Patienten mit einer diagnostizierten AHP.
Die Studie umfasste 94 Patienten mit AHP an 36 Studienorten in 18 Ländern weltweit. Die Patienten wurden 1:1 zu Givosiran oder Placebo randomisiert, wobei Givosiran mit 2,5 mg / kg monatlich subkutan verabreicht wurde.
Das wichtigste Maß für die Wirksamkeit war die annualisierte Attackenrate (annualised attack rate; AAR) der kombinierten Porphyrie-Attacken während der 6-monatigen Doppelblind-Phase und bestand aus 3 Komponenten: Attacken, die einen Krankenhausaufenthalt, einen dringenden Arztbesuch oder eine intravenöse Hämin-Verabreichung zu Hause erforderten.
Die Behandlung mit Givosiran führte bei Patienten mit AIP zu einer 74 prozentigen Reduktion der AAR der kombinierten Porphyrie-Attacken im Vergleich zu Placebo. Vergleichbare Ergebnisse konnten bei Patienten mit AHP beobachtet werden, bei denen die AAR um 73% zurückging.
Givosiran verringerte bei Patienten mit AHP im Vergleich zu Placebo außerdem die Porphyrie-Attacken in allen vordefinierten Untergruppen, einschließlich Alter, Geschlecht, ethnischer Herkunft, Region, Baseline-Body-Mass-Index (BMI), vorheriger Anwendung der Hämin-Prophylaxe, Attackenrate in der Anamnese, früherer chronischer Opioid-Anwendung in der attackenfreien Phase und dem Auftreten früherer chronischer Symptome außerhalb Attacken.
In einer Gesamteinschätzung durch die Patienten (Patient Global Impression of Change – PGIC) bewertete ein größerer Anteil der Patienten mit AIP, die mit Givosiran (61,1%) behandelt wurden ihren Gesamtstatus seit Studienbeginn als „sehr viel besser“ oder „viel besser“ als die mit Placebo behandelte Patienten (20%).














