Definition
Das Cushing-Syndrom (CS) ist die komplexe klinische Ausprägung eines Überangebots an Glukokortikoiden, welches exogen (iatrogen) oder endogen im Rahmen von Hypophysen- oder Nebennierenrinden-Pathologien verursacht wird.
Das Cushing-Syndrom tritt bei einem Überangebot von Glukokortikoiden auf, beeinflusst zahlreiche Organsysteme und führt so zu einer erhöhten Mortalität. Durch endokrine Differentialdiagnostik kann man ACTH-abhängige und ACTH-unabhängige Formen des Hypercortisolismus unterscheiden.
Cushing-Syndrom: Übersicht

Das Cushing-Syndrom (CS) ist die komplexe klinische Ausprägung eines Überangebots an Glukokortikoiden, welches exogen (iatrogen) oder endogen im Rahmen von Hypophysen- oder Nebennierenrinden-Pathologien verursacht wird.
Das exogene CS ist sehr häufig. Dem gegenüber ist das endogene CS mit 0,2-5 Fällen pro 1 Millionen Einwohner pro Jahr und einer Prävalenz von 39-79 Fällen pro Millionen Einwohnern in verschiedenen Populationen selten [1,2]. Davon entfallen 10% auf den primären bzw. Adrenokortikotropes Hormon (ACTH)-unabhängigen Hyperkortisolismus und 80% auf den sekundären bzw. ACTH-abhängigen Hyperkortisolismus [3,4].
Das mediane Erkrankungsalter liegt bei 41,4 Jahren.Insgesamt sind drei Mal so viele Frauen betroffen wie Männer. Risikofaktoren sind unkontrollierter Typ 2 Diabetes mellitus, Bluthochruck und frühe Manifestation einer Osteoporose [5,6].
Das CS wird in der Mehrzahl der Fälle exogen durch eine Langzeitbehandlung mit Glukokortikoiden oder seltener ACTH verursacht [1]. Dabei ist das CS eine iatrogene Nebenwirkung bei Überschreitung der Cushing-Schwellendosis. Diese liegt mit 30 mg Hydrocortison bei täglicher oraler Applikation geringfügig über der körpereigenen Cortisol-Produktion von 25 mg.
Beim endogenen CS liegt eine erhöhte Sekretion von Cortisol oder ACTH vor. Man kann die primäre Adrenocorticotropes Hormon (ACTH)-unabhängige Form von der sekundären ACTH-abhängigen Form unterscheiden [1,7,4].
Der primäre Hyperkortisolismus wird auch adrenales CS genannt und wird häufig durch Cortisolproduzierende Nebennierenrinden (NNR)-Tumoren, selten durch mikronoduläre Dysplasien mit PRKAR1a-Mutation oder makronoduläre Hyperplasien verursacht [7].
Bei Vorliegen eines Tumors handelt es sich bei Erwachsenen häufig um Adenome und bei Kindern zu 70% um Karzinome, wovon circa zwei Drittel virilisierend sind und eine Pseudopubertas praecox verursachen [7]. Bis zu 10% aller adrenalen Tumoren manifestieren sich bilateral.
Der sekundäre Hyperkortisolismus geht durch erhöhte ACTH-Sekretion mit einer NNR-Hyperplasie einher. Man unterscheidet die zentrale und die ektope Form. Beim zentralen CS, auch Morbus Cushing genannt, handelt es sich in ca. 80% der Fälle um Mikroadenome des Hypophysenvorderlappens (HVL).
Die restlichen Fälle des zentralen CS gehen wahrscheinlich auf eine primäre hypothalamische Überfunktion oder Autoantikörper gegen HVL-Zellen zurück. Die ektope (paraneoplastische) ACTH-Sekretion tritt am häufigsten bei kleinzelligen Lungenkarzinomen und Karzinoiden auf. Seltener können eine ektope Corticotropin-releasing Hormon (CRH)-Sekretion oder ein alkoholinduziertes Pseudo-Cushing-Syndrom ursächlich sein.
Das kleinzellige Kerngebiet des Hypothalamus bildet das Steuerhormon Corticotropin-releasing Hormone (CRH), welches über das Blut zum HVL gelangt und dort eine ACTH-Sekretion bewirkt. ACTH erreicht über den Blutweg die NNR, wo es an den ACTH-Rezeptor (MC2R) bindet und über G-Protein gekoppelte Signalwege die Glukokortikoid-Synthese stimuliert. Wird zu viel ACTH ausgeschüttet führt dies zu einer pathologisch erhöhten Synthese von Cortisol und somit zum klinischen Erscheinungsbild eines CS.
Beim primären CS ist die Glukokortikoid-Synthese unabhängig von der ACTH-Ausschüttung dysreguliert. Die negative Rückkopplung zur Regulierung des ACTH-Spiegels funktioniert im Falle eines sekundären CS nicht. Dadurch kommt es zu einer beidseitigen NNR-Hyperplasie, sodass Glukokortikoide, Androgene und in geringerem Ausmaß Aldosteron vermehrt sind.
Kortikotrophe Hypophysen-Adenome werden selten durch Mutationen, beispielsweise in MEN1, AIP oder CDKN1B, verursacht [8,9]. Nebennieren-Adenome weisen teilweise Mutationen im cAMP- oder im β-Catenin-Signalweg auf [10].
Das exogene CS unterliegt keiner Pathogenese im HVL oder der NNR. Die erhöhten Glukokortikoid-Spiegel sind auf dessen medikamentöse Zufuhr zurückzuführen.

Der erhöhte Glukokortikoidspiegel beeinflusst zahlreiche Organsysteme, sodass das CS eine breite klinische Ausprägung zeigt. Ein zirkadianer Rhythmus fehlt.
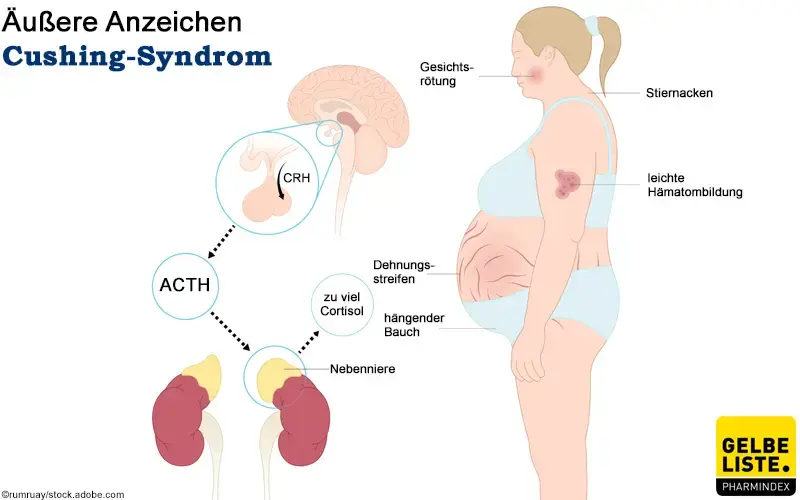
Es kommt zu einer Umverteilung der Depotfette, was zum „Vollmondgesicht“, dorsozervikaler Lipo-Hypertrophie („Stiernacken“) und Stammfettsucht führt. Eine Dysregulation des Fettstoffwechsels geht mit einer Hypercholesterinämie einher.
Glukokortikoide hemmen die Calcitriolsynthese, sodass eine Osteoporose und ggf. Knochenschmerzen möglich sind. Zusätzlich treten eine Adynamie und Myopathie mit peripher betonter Muskelatrophie auf.
Durch die diabetogene Wirkung von Glukokortikoiden kommt es außerdem zu einer herabgesetzten Glucosetoleranz.
Unter anderem durch die mineralokortikoide Wirkung der Glukokortikoide manifestiert sich in circa 85% der Fälle eine arterielle Hypertonie und ein allgemein erhöhtes kardiovaskuläres Risiko [11]. Außerdem zeigt sich in 5% der Fälle eine Hypokaliämie.
An der Haut kommt es zu Wundheilungsverzögerung, Neigung zu Akne, Furunkulose, Ulzera, Auftreten von Striae rubrae bzw. Striae distensae, Hautblutungen, Plethora und Hautatrophie [12,11]. Häufig wird ein Haarausfall beobachtet.
Im hämatopoetischen System kann man eine Vermehrung von Leuko-, Thrombo- und Erythrozyten beobachten, während Eosinophile und Lymphozyten reduziert sind.
Darüber hinaus können psychische Veränderungen wie Dysphorie, Euphorie oder depressive Episoden auftreten.
Durch allgemeine Stimulierung der Steroidsynthese in der NNR kommt es zu einem erhöhten Androgen-Spiegel. Bei Frauen kann dies zu Virilismus, Hirsutismus und Menstruationsstörungen führen. Bei Kindern tritt ein Wachstumsstörung auf [7,13].
Beim CS besteht eine erhöhte kardiovaskuläre Mortalität und beim endogenen CS zusätzlich ein erhöhtes Thromboserisiko. Das Risiko für atraumatische Frakturen in Folge der Osteoporose steigt. Durch die Störung des Kohlenhydratstoffwechsels kann sich ein Diabetes mellitus manifestieren. Neuropsychologische klinische Zeichen können sich als Folgeerkrankungen festigen.
Im Blutbild zeigt sich eine Leukozytose, Thrombozytose, Erythrozytose, Eosinopenie, Lymphopenie und Monozytopenie. Außerdem treten eine Hyperglykämie, Hyperlipidämie und Hypokaliämie auf.
Die Hormonanalytik muss in Form einer Stufendiagnostik ablaufen, wobei ein einzelner positiver Test nicht zur Sicherung oder zum Ausschluss der Diagnose ausreicht [11]. Beim CS wird eine erhöhte Ausscheidung von freiem Cortisol im 24-h-Urin, sowie ein erhöhter Cortisolspiegel in Serum und Speichel um Mitternacht beobachtet. Zur Diagnosesicherung wird zusätzlich ein niedrigdosierter Dexamethason-Kurztest durchgeführt [11]. Nach nächtlicher Gabe von 1 mg Dexamethason wird morgens das Serumcortisol bestimmt. Bei allen Formen des CS bleibt eine Supprimierung der Glukokortikoidsynthese aus und das Serumcortisol liegt über 2 µg/dl. Sowohl verschiedene Medikamente wie Kontrazeptiva und Antiepileptika als auch Grunderkrankungen wie Depression und Alkoholismus können zu falsch-positiven Ergebnissen im Dexamethason-Hemmtest führen.
Die Differentialdiagnostik dient ätiologischen Zuordnung bei gesichertem CS [14]. Der basale Plasma-ACTH-Spiegel ist bei primärem CS reduziert und bei sekundärem CS erhöht. Um das sekundäre CS weiter zu differenzieren kann eine zentrale ACTH-Bestimmung mittels Etagenblutentnahme durchgeführt werden, indem die Vv. Jugulares und der Sinus petrosi katheterisiert werden. In der Folge findet sich nur beim hypophysären Morbus Cushing und nicht beim ektopen CS ein ACTH-Konzentrationsgradient. Im CRH-Test zeigt sich beim primären und ektopen CS ein gleichbleibender ACTH- und Cortisol-Spiegel, während beim Morbus Cushing der ACTH- und Cortisol-Spiegel steigt [11]. Der hochdosierte Dexamethason-Langtest funktioniert wie der oben genannte Dexamethason-Hemmtest, aber die Dexamethason-Gabe wird in zwei aufeinanderfolgenden Nächten durchgeführt. Beim zentralen CS gelingt eine Suppression des Serumcortisols um mindestens 50%. Beim paraneoplastischen CS findet sich in einem Teil der Fälle Lipotropin (LPH), welches ein Metabolit der ACTH-Synthese ist, als Tumormarker.
Bildgebende Verfahren sollen erst nach der endokrinologischen Diagnostik bei gesichertem CS durchgeführt werden [14]. Ein CT oder MRT des Abdomens und des Schädels wird angefertigt, um Raumforderungen im Bereich der Nebenniere und der Sella turcica zu identifizieren. Mikroadenome der Sella sind nicht immer nachweisbar. Bei paraneoplastischem CS sollte eine erweiterte Tumorsuche initiiert werden. Beim adrenalem CS kann die NNR (endo)sonographisch untersucht werden.
Bei vorliegendem Verdacht auf ein exogenes CS werden nach Möglichkeit alle Glukokortikoide langsam ausgeschlichen. Bei abruptem Absetzen kann es zur Addison-Krise kommen.
Bei hormonell aktiven NNR-Tumoren wird eine offene oder endoskopische Adrenalektomie empfohlen [15]. Bei bildgebendem Verdacht auf einen benignen Tumor wird oft der laparoskopische Zugangsweg gewählt [16]. Bis sich die atrophische kontralaterale Nebenniere erholt hat, ist vorübergehend eine peri- und postoperative Substitution mit Glukokortikoiden für bis zu zwei Jahre erforderlich, um eine Addison-Krise zu verhindern. In Situationen mit erhöhtem Glukokortikoid-Bedarf, wie beispielsweise im Rahmen von febrilen Infekten oder Brechdurchfall, sollte eine Dosiserhöhung erwogen werden.
Beim hypothalamischen-hypophysären CS ist die transnasale oder transsphenoidale operative Adenomentfernung das Mittel der ersten Wahl [17]. Dabei wird eine Heilungsrate bis 80% erreicht. Eine postoperative Normalisierung des ACTH-Spiegels und ein postoperativ vorübergehend auftretender Hypokortisolismus gelten als Erfolgskontrolle. Eine temporäre Glukokortikoid-Substitution ist analog zur Therapie des primären CS indiziert. Eine Fraktionierte (Protonen-)Bestrahlung oder Radiochirurgie (z. B. Gamma-knife) bietet eine Alternative zur Operation [17]. Der Wirkungseintritt ist erst nach Jahren. Das Somatostatinanalogon Pasireotid kann als Monotherapie oder bei therapieresistenten Fällen in Kombination mit Cabergolin angewendet werden [18]. Als ultima ratio kann eine bilaterale Adrenalektomie erwogen werden, was eine lebenslange Substitution von Glukokortikoiden erforderlich macht [19]. Es kommt danach in 20% der Fälle zur Ausbildung eines Nelson-Tumors.
Eine primär medikamentöse Therapie wird bei inoperablen NNR-Karzinomen oder inoperablem Tumor mit ektoper paraneoplastischer ACTH-Bildung angewendet. Steroidgenese-Inhibitoren wie Ketoconazol und Metyrapon kommen neben adrenostatischen Substanzen wie o-p-DDD (Mitotan) zum Einsatz [20]. Häufig ist eine Kombinationstherapie mit klassische Zytostatika wie Etoposid, Anthracyclinen oder Platinderivaten indiziert.
Bei nicht-maligner Ursache eines CS ist die Standard Mortalität Rate (SMR) um 2,4 bis 4,0 erhöht und kardiovaskuläre Todesursachen sind am häufigsten [21,22]. Langfristige Remission verbessern in manchen Studien die SMR, aber normalisieren sie nicht [22]. Sofortige und langfristige Remissionsraten nach Hypophysen-Operation sinken bei Makroadenomen, duraler oder kavernoser Invasion, postoperativem Eukortisolismus und bei Abwesenheit eines Tumors in der Pathologischen Einschätzung [23]. Bei fehlender Therapie und chronischem Hyperkortisolismus kommt es zu Multisystem-Morbidität [24]. Die Lebensqualität ist beim CS durch physische und psychologische Faktoren deutlich reduziert und bildet sich oft auch nach Remission nicht vollständig zurück.
Das Auftreten des häufigeren exogenen CS kann durch gut überwachte Glukokortikoid-Therapieschemata verringert werden. Für das endogene CS gibt es keine Prophylaxe.
Anzeige