Etwa 15 bis 20% der metastasierten Brustkrebserkrankungen sind durch eine Überexpression oder Amplifikation des humanen epidermalen Wachstumsfaktorrezeptors 2 (HER2) gekennzeichnet. Die empfohlene Erstlinientherapie besteht aus den monoklonalen Anti-HER2-Antikörpern Trastuzumab und Pertuzumab, verabreicht mit einem Taxan. In der CLEOPATRA-Studie (Clinical Evaluation of Pertuzumab and Trastuzumab) führte die Kombination von Trastuzumab, Pertuzumab und Docetaxel zu einer medianen Dauer des progressionsfreien Überlebens und des Gesamtüberlebens von 18,7 Monaten bzw. 56,5 Monaten.
Die Standard-Zweitlinientherapie ist das Antikörper-Wirkstoff-Konjugat Trastuzumab Emtansin, das mit einem objektiven Ansprechen von 43,6% (95% Konfidenzintervall [KI]: 38,6-48,6) und einer medianen Dauer des progressionsfreien Überlebens von 9,6 Monaten verbunden war, wenn das Medikament nach Trastuzumab und einem Taxan verabreicht wurde.
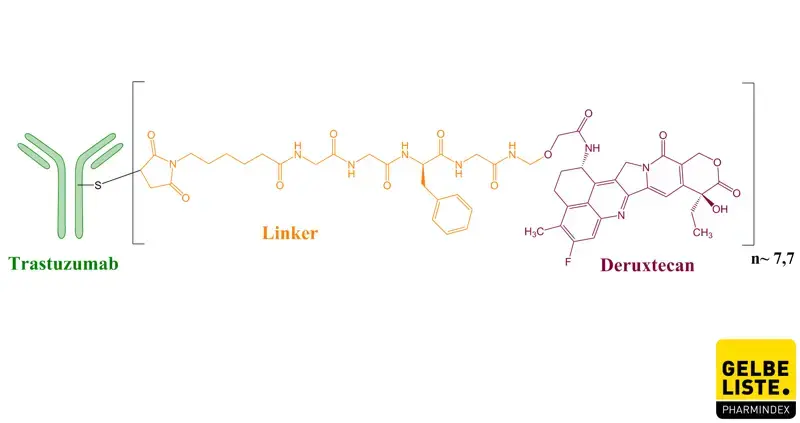
Schließlich wurde Trastuzumab-Deruxtecan entwickelt, um die kritischen Eigenschaften der zu dieser Zeit erhältlichen Antikörper-Wirkstoff-Konjugate zu verbessern. Das Präparat weist beispielsweise ein höheres Wirkstoff-Antikörper-Verhältnis als Trastuzumab Emtansin (etwa 8 gegenüber 3 bis 4) auf und behält gleichzeitig ein günstiges pharmakokinetisches Profil bei.
Was ist Enhertu und wofür wird es angewendet?
Enhertu (Trastuzumab-Deruxtecan) ist ein HER2-gerichtetes Antikörper-Wirkstoff-Konjugat, das gemeinsam von AstraZeneca und Daiichi Sankyo entwickelt wurde und als Monotherapie zur Behandlung von inoperablem oder metastasiertem HER2-positivem Brustkrebs bei Patientinnen indiziert ist, die bereits mindestens zwei gegen HER2 gerichtete Vorbehandlungen erhalten haben.
Das Präparat besteht aus einem humanisierten monoklonalen Anti-HER2-IgG1-Antikörper, der über einen Tetrapeptid-basierten abspaltbaren Linker kovalent an das Zytostatikum Deruxtecan, ein potenter Topoisomerase-I-Inhibitor, gebunden ist. An jedes Antikörpermolekül sind ungefähr acht Deruxtecan-Moleküle gebunden.
Wie wird Enhertu angewendet?
Enhertu ist zur intravenösen Anwendung bestimmt und darf nicht als intravenöse Druck- oder Bolusinjektion gegeben werden. Je nach Verträglichkeit können zur Prophylaxe oder Behandlung Antiemetika gegeben werden. Wenn der Patient infusionsbedingte Symptome zeigt, muss die Infusionsgeschwindigkeit von Enhertu reduziert oder die Infusion unterbrochen werden.
Anwendungshinweise
Unter der Anwendung von Enhertu kam es zu einigen Fällen von interstitieller Lungenerkrankung (ILD) und/oder Pneumonitis, die zum Teil tödlich endeten. Patienten müssen deshalb darauf hingewiesen werden Symptome wie Husten, Dyspnoe, Fieber und/oder neue oder sich verschlechternde Atemwegssymptome unverzüglich dem behandelnden Arzt zu melden. Bei Verdacht auf ILD/Pneumonitis ist dann eine Röntgenuntersuchung, vorzugsweise eine Computertomographie (CT), durchzuführen.
Dosierung
Die empfohlene Dosis von Enhertu beträgt 5,4 mg/kg und wird als intravenöse Infusion einmal alle drei Wochen (21-tägiger Zyklus) bis zur Krankheitsprogression oder bis zum Auftreten einer inakzeptablen Toxizität angewendet.
Die Initialdosis ist als 90-minütige intravenöse Infusion zu geben. Wenn die vorausgegangene Infusion gut vertragen wurde, können die nachfolgenden Dosen von Enhertu als 30-minütige Infusionen gegeben werden.
Wie wirkt Enhertu?
Trastuzumab-Deruxtecan ist ein gegen HER2 gerichtetes Antikörper-Wirkstoff-Konjugat. Der Antikörper ist ein humanisierter Anti-HER2-IgG1-Antikörper, der über einen abspaltbaren Linker auf Tetrapeptidbasis an Deruxtecan, einen Topoisomerase-I-Inhibitor (DXd), gebunden ist. Nach der Bindung an HER2 durch Trastuzumab kommt es zu einer Internalisierung des Trastuzumab-Deruxtecan-Komplexes und der proprietäre Linker wird in der Zelle durch Cathepsine abgespalten, die in Tumorzellen hochreguliert sind. Nach der Freisetzung verursacht das membrangängige Deruxtecan DNA-Schäden, was zur Apoptose der Tumorzelle führt.
Deruxtecan ist etwa 10-mal wirksamer als der aktive Metabolit von Irinotecan SN-38.