Wie die EMA in ihrer Pressemitteilung verkündet, kam der Ausschuss für Humanarzneimittel (CHMP) einvernehmlich zu dem Schluss, dass die Daten zu Nuvaxovid robust seien und die EU-Kriterien für Wirksamkeit, Sicherheit und Qualität erfüllen. Die EU-Kommission erteilte daraufhin die bedingte Zulassung. Für nächstes Jahr sollen der EU bis zu 200 Millionen Dosen des Impfstoffes bereitgestellt werden. Nach Angaben der EU-Kommission haben die Mitgliedstaaten für das erste Quartal rund 27 Millionen Dosen bestellt, genug, um etwa 13,5 Millionen Menschen zu impfen.
Was ist Nuvaxovid und wofür wird es angewendet?
Nuvaxovid (NVX-CoV2373) des US-Herstellers Novavax ist der fünfte in der EU zugelassene Corona-Impfstoff zur Vorbeugung von COVID-19 und der erste proteinbasierte Impfstoff für die Prävention von COVID-19 in der EU. Die Vakzine ist als gebrauchsfertige Flüssigformulierung in einem Fläschchen von 0,5 ml mit zehn Dosen konfektioniert und wird bei 2 bis 8°C gelagert.
Wie wird Nuvaxovid angewendet?
Nuvaxovid wird intramuskulär in den Deltamuskel des Oberarms appliziert.
Dosierung
Die empfohlene Dosis von Nuvaxovid beträgt zwei Dosen zu je 0,5 ml (5 Mikrogramm des SARS-CoV-2-Spike-Proteins) im Abstand von drei Wochen.
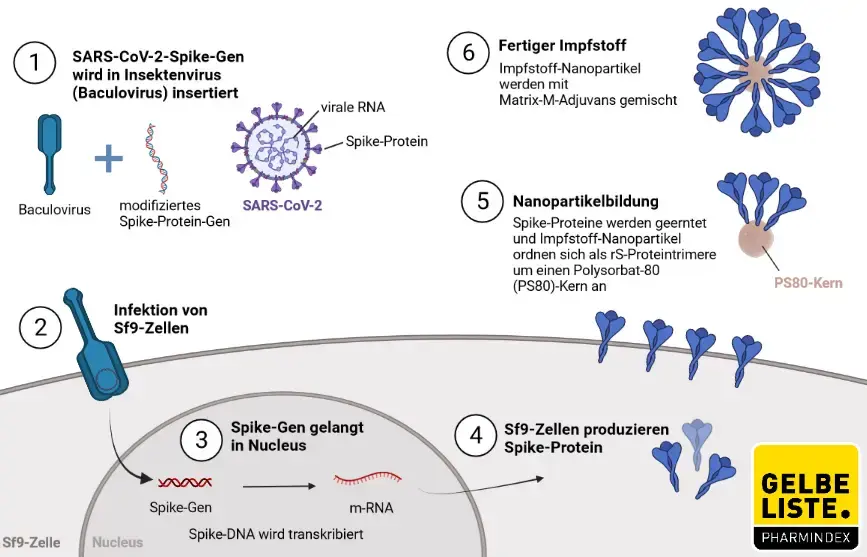
Herstellung
Wie wirkt Nuvaxovid?
Nuvaxovid ist ein proteinbasierter Impfstoff, der virusähnliche Partikel (Virus like Particles, VLP) enthält, die das Spike-Protein von SARS-CoV-2 präsentieren und zusammen mit einem Matrix-M1-Adjuvans in Nanopartikeln formuliert sind. Dieses Adjuvans verbessert die Immunantwort und stimuliert neutralisierende Antikörper. Das patentierte Matrix-M-Adjuvans auf Saponin-Basis von Novavax konnte eine starke und gut verträgliche Wirkung zeigen. Nach Herstellerangaben stimuliert es den Eintritt von Antigen-präsentierenden Zellen in die Injektionsstelle, verbessert die Antigen-Präsentation in lokalen Lymphknoten und verstärkt die Immunantwort. Die beiden Impfstoffkomponenten lösen B- und T-Zell-Immunantworten auf das Spike-Protein aus, einschließlich neutralisierender Antikörper.
Gegenanzeigen
Nuvaxovid darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile:
Adjuvans (Matrix-M):
Nebenwirkungen
Die Sicherheit von Nuvaxovid wurde anhand einer Zwischenanalyse gepoolter Daten aus fünf laufenden klinischen Studien in Australien, Südafrika, Großbritannien, den Vereinigten Staaten und Mexiko bewertet. Zum Zeitpunkt der Analyse erhielten insgesamt 49.950 Teilnehmer im Alter von 18 Jahren und älter mindestens eine Dosis Nuvaxovid (n=30.058) oder Placebo (n=19.892). Das Durchschnittsalter lag bei 48 Jahren (Spanne 18 bis 95 Jahre). Die mediane Nachbeobachtungsdauer betrug 70 Tage nach der zweiten Dosis. Bei 32.993 Teilnehmern (66%) erfolgte die Nachbeobachtung über mehr als zwei Monate nach der zweiten Dosis.
Von den gepoolten Reaktogenitätsdaten, die Teilnehmer ab 18 Jahren einschlossen, die in die beiden Phase-III-Studien aufgenommen wurden und mindestens eine Dosis Nuvaxovid (n=19.898) oder Placebo (n=10.454) erhielten, waren die häufigsten Nebenwirkungen:
- Empfindlichkeit an der Injektionsstelle (75%)
- Schmerzen an der Injektionsstelle (62%)
- Müdigkeit (53%)
- Muskelschmerzen (51%)
- Kopfschmerzen (50%)
- Unwohlsein (41%)
- Arthralgie (24%)
- Übelkeit oder Erbrechen (15%)
Die Nebenwirkungen waren in der Regel leicht bis mittelschwer mit einer medianen Dauer von ≤ 2 Tagen für lokale Nebenwirkungen und ≤ 1 Tag für systemische Ereignisse nach der Impfung.
Insgesamt trat eine höhere Inzidenz von Nebenwirkungen in jüngeren Altersgruppen auf: Die Inzidenz der genannten Nebenwirkungen war bei Erwachsenen im Alter von 18 bis unter 65 Jahren höher als bei den über 65-Jährigen.
Lokale und systemische Nebenwirkungen wurden nach der zweiten Impfung häufiger berichtet als nach der ersten Impfung.
Wechselwirkungen
- Die gleichzeitige Anwendung von Nuvaxovid mit inaktivierten Influenza-Impfstoffen wurde an einer begrenzten Zahl von Teilnehmern in einer explorativen klinischen Sub-Studie untersucht.
- Die Antikörperantwort auf SARS-CoV-2 fiel geringer aus, wenn Nuvaxovid gleichzeitig mit einem inaktivierten Influenza-Impfstoff verabreicht wurde. Die klinische Bedeutung davon ist unbekannt.
- Die gleichzeitige Anwendung von Nuvaxovid mit anderen Impfstoffen wurde nicht untersucht.
Studienlage
Grundlage der Zulassung bilden die Ergebnisse zweier klinischer Hauptstudien, die zeigen, dass Nuvaxovid bei der Vorbeugung von COVID-19 bei Menschen ab 18 Jahren wirksam war. An den Studien nahmen insgesamt über 45.000 Personen teil.
Studie 1 (2019nCoV-301)
Studie 1 ist eine laufende multizentrische, randomisierte, beobachterblinde, placebokontrollierte klinische Phase-III-Studie an Teilnehmern ab 18 Jahren in den USA und Mexiko. Bei der Einschreibung waren die Teilnehmer stratifiziert nach Alter (18 bis 64 Jahre und ≥ 65 Jahre) und im Verhältnis 2:1 der Behandlung mit Nuvaxovid oder Placebo zugeordnet. Die primäre Wirksamkeitsanalysepopulation (als Per-Protocol Efficacy [PP-EFF]-Analyseset bezeichnet) umfasste 25.452 Teilnehmer, die entweder Nuvaxovid (n=17.312) oder Placebo (n=8.140) bekamen.
Ergebnisse
Die Impfstoffwirksamkeit von Nuvaxovid zur Verhinderung von COVID-19 sieben Tage nach der zweiten Dosis betrug 90,4% (95%-KI: 82,9 – 94,6). Bei den 17.312 Nuvaxovid-Teilnehmern wurden keine Fälle von schwerem COVID-19 gemeldet, verglichen mit 4 Fällen von schwerem COVID-19 bei den 8.140 Probanden der Placebo-Gruppe.
Subgruppenanalysen des primären Wirksamkeitsendpunkts zeigten ähnliche Wirksamkeitspunktschätzungen für männliche und weibliche Teilnehmer und ethnische Gruppen sowie bei Teilnehmern mit medizinischen Komorbiditäten, die mit einem hohen Risiko für schweres COVID-19-Verläufe verbunden sind. Es gab keine signifikanten Unterschiede in der Gesamtwirksamkeit des Impfstoffs bei Teilnehmern mit einem erhöhten Risiko für schweres COVID-19, einschließlich derer mit einer oder mehreren Komorbiditäten, die das Risiko für schweres COVID-19 erhöhen (z. B. BMI ≥ 30 kg/m2, chronische Lungenerkrankung, Diabetes mellitus Typ 2, Herz-Kreislauf-Erkrankungen und chronische Nierenerkrankungen).
Wirksamkeit gegenüber Corona-Varianten
Für 61 der 77 Endpunktfälle (79%) lagen Sequenzierungsdaten vor. Von diesen wurden 48 von 61 (79%) als besorgniserregende Varianten (VOC) oder Varianten von Interesse (VOI) identifiziert. Die am häufigsten identifizierten besorgniserregenden Varianten waren: Alpha mit 31/61 Fällen (51%), Beta (2/61,4 %) und Gamma (2/61,4 %), während die häufigsten Varianten von Interesse Iota mit 8/61 Fälle (13%) und Epsilon (3/61, 5%) waren.
Studie 2 (2019nCoV-302)
Studie 2 ist eine laufende multizentrische, randomisierte, beobachterblinde, placebokontrollierte klinische Phase-III-Studie an Teilnehmern im Alter von 18 bis 84 Jahren in Großbritannien. Bei der Einschreibung wurden die Teilnehmer stratifiziert nach Alter (18 bis 64 Jahre; 65 bis 84 Jahre), und Nuvaxovid oder Placebo zugeteilt.
Die Einschreibung wurde im November 2020 abgeschlossen. Die Teilnehmer werden bis zu 12 Monate nach der Grundimmunisierung zur Bewertung der Sicherheit und Wirksamkeit gegen COVID-19 nachbeobachtet. Das Set zur primären Wirksamkeitsanalyse (PP-EFF) umfasste 14.039 Teilnehmer, die entweder Nuvaxovid (n=7.020) oder Placebo (n=7.019) erhielten.
Ergebnisse
Die Impfstoffwirksamkeit von Nuvaxovid zur Verhinderung von COVID-19 sieben Tage nach der zweiten Dosis betrug 89,7% (95%-KI: 80,2 – 94.6). Bei den 7.020 Nuvaxovid-Teilnehmern wurden keine Fälle von schwerem COVID-19 gemeldet, verglichen mit 4 Fällen von schwerem COVID-19 bei den 7.019 Probanden unter Placebo.
Wirksamkeit gegenüber Corona-Varianten
Für 95 der 106 Endpunktfälle (90%) lagen Daten zu Coronavarianten vor: 66 von 95 Fällen (69%) wurden als Alpha-Variante identifiziert, während die anderen Fälle als Nicht-Alpha klassifiziert wurden.
Omikron-Wirkung wird angezweifelt
Da Nuvaxovid im Gegensatz zu den anderen vier zugelassenen Corona-Impfstoffen nur eine humorale Immunantwort erzeugt, wird die Wirksamkeit des Impfstoffs gegenüber der neuen Omikron-Variante von Fachleuten sehr kritisch beäugt. Omikron muss nämlich hauptsächlich zytotoxisch bekämpft werden, da die Variante die humorale Immunantwort unterlaufen kann.
Zur Erklärung: Sowohl die beiden mRNA-Impfstoffe Comirnaty und Spikevax, als auch die zwei Vektor-Impfstoffe Vaxzevria und die COVID-19-Vakzine Janssen sind "Totimpfstoffe", die sich allerdings aufgrund der zellinternen Spike-Protein-Produktion wie "Lebendimpfstoffe" verhalten; Totimpfstoffe können nur eine humorale Immunantwort bewirken (Antikörper durch B-Zellen), während Lebenimpfstoffe sowohl eine humorale als auch zytotoxische Immunantwort auslösen (Antikörper durch B-Zellen, zytotoxische Antwort durch T-und NK-Zellen).