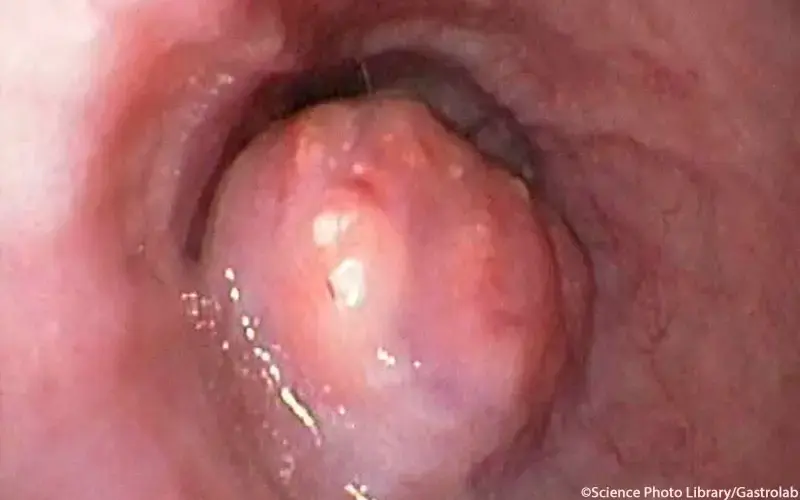
Pathogenese
Adenokarzinome
Prinzipiell können sich Adenokarzinome im Bereich der Speiseröhre aus persistierenden Zylinderepithelinseln, aber auch aus intraösophagealen Schleimdrüsen und der heterotopen gastrischen Mukosa entwickeln. Die Mehrheit aller Adenokarzinome entsteht auf dem Boden einer refluxbedingten Veränderung im distalen Ösophagus, der sogenannten präneoplastischen Barrett-Metaplasie. Diese lässt sich bei mehr als 80 Prozent der Patienten mit ösophagealen Adenokarzinomen nachweisen. Im Barrett-Ösophagus wird das normale Plattenepithel des distalen Speiseröhrenabschnitts durch ein intestinalisiertes Epithel aus einschichtigem Zylinderepithel mit Becherzellen ersetzt.
Das Malignom entwickelt sich sequentiell in mehrstufigen Prozessen über „low-grade“ zu „high-grade“ intraepithelialen Neoplasien (IEN) bis hin zum invasiven Adenokarzinom. Im Verlauf dieser Metaplasie-Dysplasie-Karzinom-Abfolge finden sich:
- eine zunehmende genomische Instabilität mit Abnormalitäten im Zellzyklus
- aneuploide Zellfraktionen
- Mutationen in einer Reihe von Onkogenen und Tumorsuppressorgenen
- eine verminderte Expression von Zelladhäsionsmolekülen
Plattenepithelkarzinome
Plattenepithelkarzinome gehen meist auf eine initiale mechanische Schädigung der Ösophagusschleimhaut, zuweilen in Kombination mit toxischen karzinogenen Substanzen, zurück. Die Karzinogene sind ebenso für Zweit-Plattenepithelkarzinome im Kopf-Hals-Bereich oder in der Lunge verantwortlich. Pathogenetisch spielt die Inaktivierung des Tumorsuppressorgens p53 eine entscheidende Rolle. Diese bei bis zu 55 Prozent aller Patienten mit ösophagealen Plattenepithelkarzinomen nachgewiesene Veränderung bewirkt eine Transformation des Zylinderepithels zur Zylinderepitheldysplasie.
Zur Tumorprogression beim Ösophagus-Plattenepithelkarzinom tragen ferner die Tumorsuppressorgene p16 und das Fragile Histidine Triad-Gen (FHIT-Gen) sowie die Amplifikation/Überexpression von Cyclin D1 bei. Eine Inaktivierung von p16 bewirkt unter anderem eine unkontrollierte Zellproliferation. Das FHIT-Gen reagiert besonders empfänglich auf die Einwirkung chemischer Karzinogene. Eine Überexpression von Cyclin D1 ist mit einer vermehrten Anzahl von Lymphknotenmetastasen, hohen Tumorproliferationsraten, ungünstiger Prognose und einem schlechten chemotherapeutischen Ansprechen assoziiert.
Lokalisation, Morphologie
In Abhängigkeit von der Lage wird zwischen zervikalen, intrathorakalen und gastroösophagealen Übergangskarzinomen bzw. AEG-Karzinomen unterschieden; histopathologisch vor allem zwischen epithelialen Tumoren und nicht-epithelialen Tumoren.
Zu den epithelialen Ösophagusmalignomen gehören:
- Adenokarzinome
- Plattenepithelkarzinome
- adenosquamöse Karzinome
- Mukoepidermoidkarzinome
- adenoid-zystische Karzinome
- kleinzellige Karzinome
- undifferenzierte Karzinome
- pseudosarkomatöse Karzinome
Nicht-epitheliale bzw. mesenchymale maligne Speiseröhrentumoren sind das Leiomyosarkom und das Kaposi-Sarkom.
Morphologisch erfolgt die Einteilung in:
- Carcinoma in situ (CIS): makroskopisch als erhabene oder flache Epithelverdickung oder als eingesunkene Verdünnung des Schleimhautepithels sichtbar, entweder weißlich (Leukoplakie), rötlich (Erythroplasie) oder unverändert (okkult), Auftreten in 10–20% der Fälle solitär und in 80–90% der Fälle multipel
- polypöses Karzinom: mit circa 60% am häufigsten, oft frühes Tumorstadium; im Verlauf Übergang in ulzerierte Form möglich, mit oder ohne Wandinfiltration
- ulzeröses Karzinom: etwa 25% der Fälle, unregelmäßig begrenztes hämorrhagisches Ulkus mit wallartig erhabenen Rändern
- diffus infiltrierendes Karzinom: etwa 15% der Fälle, Infiltrationen bis weit in die benachbarte Ösophaguswand und in den Tracheobronchialtrakt, sehr aggressives Karzinom mit schlechter Prognose
- variköses Karzinom: ähnelt endoskopisch und röntgenologisch Ösophagusvarizen
Symptome
Ösophaguskarzinome werden in der Regel erst spät symptomatisch. Klassisches Leitsymptom – wenn auch meist im fortgeschrittenen Stadium bei einer Lumeneinengung von mehr als 50 Prozent – ist Dysphagie. Betroffene verspüren häufig ein Feststecken von Nahrungsbestandteilen (erst trockene/feste, später auch breiige/flüssige Speisen), sodass sie zu wiederholten Schluckbewegungen gezwungen sind.
Weitere Befunde komplettieren das klinische Bild:
- Regurgitation unverdauter Nahrung
- retrosternale Beschwerden (Schmerzen, Druckgefühl, Brennen)
- Völlegefühl
- Nausea und Emesis
- Husten und Heiserkeit (bei Infiltration des N. laryngeus recurrens)
- Pseudohypersalivation (bei vollständiger Verlegung des Ösophaguslumens)
- Hämatemesis und Melaena (als Zeichen gastrointestinaler Blutungen)
- Lymphadenopathie, vor allem zervikal
- rezidivierende Aspiration/Pneumonien
- frühes Sättigungsgefühl, Inappetenz
- Gewichtsverlust bis zur Tumorkachexie
TNM-Klassifikation
Die TNM-Klassifikation der Eindringtiefe des Primärtumors, der Lymphknotenmetastasierung und Fernmetastasierung sowie die Stadieneinteilung der Ösophaguskarzinome erfolgt nach den Richtlinien der UICC (International Union against Cancer).
Tumor:
- TX Primärtumor nicht beurteilbar
- T0 kein Anhalt für Primärtumor
- Tis Carcinoma in situ
- T1 Tumor infiltriert Lamina propria, Muscularis mucosae und Submukosa
o T1a Infiltration der Lamina propria oder Muscularis mucosae
o T1b Infiltration der Submukosa - T2 Tumor infiltriert Muscularis propria
- T3 Tumor infiltriert Adventitia
- T4 Tumor infiltriert Nachbarstrukturen
o T4a Infiltration von Pleura, Perikard, Vena azygos, Zwerchfell oder Peritoneum
o T4b Infiltration von Aorta, Wirbelkörper oder Trachea
Regionäre Lymphknoten (LK):
- NX regionäre LK nicht beurteilbar
- N0 keine regionären LK-Metastasen
- N1 Metastasen in 1–2 regionären LK
- N2 Metastasen in 3–6 regionären LK
- N3 Metastasen in 7 oder mehr regionären LK
Fernmetastasen:
- M0 keine Fernmetastasen
- M1 hämatogene Fernmetastasen oder nicht-regionäre LK
Für Tumoren des unteren thorakalen Ösophagus
o M1a Metastase(n) in zöliakalen Lymphknoten
o M1b andere Fernmetastasen
Für Tumoren des oberen thorakalen Ösophagus
o M1a Metastase(n) in zervikalen Lymphknoten
o M1b andere Fernmetastasen
Für Tumoren des mittleren thorakalen Ösophagus
o M1a nicht anwendbar
o M1b nichtregionäre Lymphknoten oder andere Fernmetastasen
Stadieneinteilung
Das klinische Stadium von Plattenepithelkarzinomen wird folgendermaßen kategorisiert:
| | T-Kategorie | N-Kategorie | M-Kategorie |
| Klinisches Stadium - Plattenepithelkarzinome |
| Stadium 0 | Tis | N0 | M0 |
| Stadium I | T1 | N0, N1 | M0 |
| Stadium II | T2 | N0, N1 | M0 |
| T3 | N0 | M0 |
| Stadium III | T1, T2 | N2 | M0 |
| T3 | N1, N2 | |
| Stadium IVA | T4a, T4b | Jedes N | M0 |
| Stadium IVA | Jedes T | N3 | M0 |
| Stadium IVB | Jedes T | Jedes N | M1 |
Siewert-Klassifikation
Adenokarzinome des gastroösophagealen Übergangs gehören seit der 7. Auflage der TNM-Klassifikation und den UICC-Richtlinien zur Gruppe der Ösophaguskarzinome und werden anhand der Siewert-Klassifikation in drei Typen unterteilt:
- Typ I: Karzinom im distalen Ösophagus lokalisiert, Tumorzentrum 1 bis 5 cm oberhalb der Z-Linie
- Typ II: Kardiakarzinom im eigentlichen Sinne, Tumorzentrum 1 cm oberhalb bis 2 cm unterhalb der Z-Linie
- Typ III: subkardiale Raumforderung, Tumorzentrum zwischen 2 und 5 cm unterhalb der Z-Linie
AEG vom Typ I basieren meist auf einer intestinalen Metaplasie des Barrett-Ösophagus. Typ II und III sind regelhaft mit Helicobacter-pylori-Infektionen assoziiert.
Metastasierung
Klassischerweise metastasieren Ösophaguskarzinome:
- Lymphogen: früh; primär in regionäre Lymphknoten entlang der Ösophaguswand, später – je nach Lokalisation des Tumors – in paraösophageale, zervikale, paratracheale, parabronchiale, hiläre, gastrale und zöliakale Lymphknotenareale. Im Vergleich zum ösophagealen Plattenepithelkarzinom entwickeln sich beim Adenokarzinom später Lymphknotenmetastasen.
- infiltrativ: relativ früh; Infiltrationen vor allem in Trachea und Wirbelkörper
- hämatogen: spät, Fernmetastasen finden sich bei proximalen Karzinomen (obere Ösophagushälfte) vornehmlich in der Lunge und Pleura, bei distalen Malignomen (untere Ösophagushälfte) und AEG-Tumoren in der Leber. Metastasen in anderen Organen oder dem Skelettsystem werden in der Regel erst sehr spät beobachtet.
Diagnostik
Erste Hinweise auf die Diagnose Ösophaguskarzinom geben Anamnese und die klinische Untersuchung. Bei Adenokarzinomen liegt häufig eine langjährige Refluxanamnese, bei Plattenepithelkarzinomen eine jahrelange Alkoholanamnese vor. Anschließend folgen bildgebende Verfahren, speziell Endoskopien (inklusive Biopsien) und Computertomografien (CT).
Endoskopische Verfahren
Alle Patienten mit neu aufgetretener Dysphagie, gastrointestinaler Blutung, rezidivierender Aspiration, wiederholtem Erbrechen, Dyspepsie, ungewolltem Gewichtsverlust und/oder Inappetenz sollen frühzeitig endoskopiert werden. Als Standardverfahren hat sich die Ösophagogastroduodenoskopie (ÖGD) mittels hochauflösender Videoendoskopie etabliert.
Um Dysplasien und frühe neoplastische Läsionen bei Patienten mit erhöhtem Ösophaguskarzinom-Risiko (zum Beispiel bei Alkohol- und/oder Nikotinabusus sowie Patienten mit anamnestischen oro-/nasopharyngealen Plattenepithelkarzinomen) zeitig zu erkennen, werden Chromoendoskopien oder computergestützte digitale (Filter-) Verfahren empfohlen.
Chromoendoskopie
Bei der Chromoendoskopie mit Lugol’scher Lösung (Schiller-Jodprobe) wird die Ösophagusschleimhaut mit einer Jod-Kaliumjodid-Mischung gefärbt. Im Gegensatz zum normalen Plattenepithel, das nach Auftragen der Flüssigkeit bräunlich erscheint, fehlt die Anfärbung bei Frühkarzinomen und seinen Vorstufen.
Virtuelle chromoendoskopische Verfahren
Zur neuesten Generation der virtuellen Chromoendoskopien gehören Narrow-Band-Imaging (NBI), Flexible Spectral-Imaging Color Enhancement (FICE) oder iScan. Bei diesen Verfahren wird die Ösophagusschleimhaut mit hochauflösenden Video-Endoskopen, die durch selektive Farbfiltertechniken Mukosa-Merkmale hervorheben, betrachtet. So lassen sich makroskopisch nicht-sichtbare Veränderungen histologisch vorhersagen.
Hochauflösende endoskopische Verfahren
In spezialisierten Zentren kommen zunehmend moderne, hochauflösende endoskopische Verfahren wie die Endozytoskopie, die konfokale Laserscanning-Endomikroskopie oder die optische Kohärenztomographie zum Einsatz.
Weitere Bildgebung
Zur Abklärung der Lagebeziehung zwischen Ösophaguskarzinom und Tracheobronchialtrakt ist die hochauflösende Computertomografie (CT) des Mediastinums am zielführendsten. Eine Röntgen-Breischluck-Untersuchung unter Darstellung des gesamten Thorax erlaubt ebenso eine indirekte Zuordnung von Primärtumor und Trachealbifurkation (zur Primärdiagnostik nicht mehr empfohlen). Darüber hinaus dienen beide Verfahren zur Detektion von Tracheobronchial- oder Mediastinalfisteln.
Biopsie und Histologie
Unabhängig vom endoskopischen Verfahren müssen Biopsien aus allen suspekten Läsionen genommen werden, beim Barrett-Ösophagus zusätzlich 4-Quadranten-Biopsien. Eine Gewebeentnahme mit histologischer Untersuchung ist bis heute unerlässlich. Sie dient der:
- histologischen Sicherung und Differenzierung
- Beurteilung des Gradings
- Bestimmung eventueller molekularer Prognosefaktoren
Nach der gültigen WHO-Klassifikation werden Dysplasien und intraepitheliale Neoplasien graduiert in:
- negativ
- unklar/fraglich
- niedriggradig (low grade/LGD/LGIEN)
- hochgradig (high grade/HGD/HGIEN)
Der histopathologische Befund sollte folgende Aspekte beinhalten:
- Art der neoplastischen Läsion, insbesondere ob ein invasives Karzinom vorliegt (bei HGD/HGIEN: Klassifikation am Biopsat als Tis nach UICC)
- histologischer Typ nach WHO (speziell die Unterscheidung Plattenepithel- versus Adenokarzinom)
- bei invasiven Adenokarzinomen Differenzierungsgrad (Grading) nach aktueller WHO-Klassifikation
- bei Läsionen im distalen Ösophagus Vorhandensein einer Becherzell-haltigen Barrett-Mukosa
Bei histologischer Diagnose einer intraepithelialen Neoplasie im Barrett-Ösophagus wird der Prozess einer kompetenten (dokumentierten) pathologischen Zweitmeinung im Sinne eines Vier-Augen-Prinzips empfohlen. Bei Dissens oder Unsicherheit bezüglich der Dysplasiediagnose ist eine externe Begutachtung angezeigt.
Staging
Die Prognose des Ösophaguskarzinoms korreliert deutlich mit dem TNM-Stadium. Ein exaktes, prätherapeutisches Schnittbild-Staging ist deshalb obligat.
Geeignete Verfahren sind:
- Abdomensonografie (B-Bild-Sonografie als bevorzugtes Initialverfahren), ggf. kontrastverstärkend (CEUS)
- CT-Aufnahmen von Thorax und Abdomen. Zum primären Staging wird bei Patienten mit einem neu diagnostizierten Ösophaguskarzinom eine Multidetektor-CT (MDCT) von Hals/Thorax und Abdomen empfohlen; zur Verbesserung des T-Stagings stets mit einer Wanddistension (vornehmlich negatives, orales Kontrastmittel). Zusätzlich zur Negativ-Kontrastierung ist eine i.v. Kontrastmittelgabe mit jodhaltigem Kontrastmittel obligat. Kann keine CT erfolgen, ist eine MRT indiziert.
- flexible Bronchoskopie mit Biopsie
- Stützlaryngoskopie
- diagnostische Laparoskopie (insbesondere zum Nachweis von Lebermetastasierung und Peritonealkarzinose bei AEG-Karzinomen)
- Positronenemissionstomografie (PET) bei lokal fortgeschrittenen Tumoren
- ggf. Skelettszintigrafie
Labor
Die labordiagnostische Untersuchung umfasst in erster Linie:
- Blutbild
- Blutgerinnung
- Leber- und Nierenfunktionsparameter
- TSH
Die Bestimmung von laborspezifischen zirkulierenden Tumormarkern (SCA bei Plattenepithelkarzinomen, CEA bei Adenokarzinomen) wird gemäß der aktuellen S3-Leitlinie Ösophaguskarzinom (Stand: Dezember 2018) weder zur Primärdiagnose noch zur Verlaufskontrolle empfohlen.
Therapie
Über Art und Umfang der Therapie eines Ösophaguskarzinoms sollte interdisziplinär diskutiert und entschieden werden. Abhängig von Diagnosezeitpunkt und Tumorklassifikation beziehungsweise Staging wird in einer sogenannten Tumorkonferenz das Behandlungskonzept festgelegt. Grundsätzlich ist zwischen kurativem und palliativem Therapieansatz zu wählen. Entscheidend sind dabei:
- patientenbezogene Charakteristika wie Allgemeinzustand und Komorbiditäten
- tumorspezifische Merkmale wie Tumorausdehnung und Metastasierung (TNM-Stadium)
- Histologiebefund
- Lokalisation des Tumors
- Patientenpräferenz
Voraussetzungen für eine kurative Therapie sind:
- keine Fernmetastasierung
- lokal wenig fortgeschrittene Raumforderung
- ausreichender Allgemein- und Ernährungszustand
- befriedigende kardiopulmonale Suffizienz
Bei der kurativen Primärbehandlung stehen folgende Optionen zur Wahl:
- endoskopische Resektion (ER) bei Frühkarzinomen
- alleinige Operation
- Kombination einer neoadjuvanten präoperativen Radiochemotherapie plus Operation
- alleinige Radiochemotherapie
Das palliative Konzept umfasst unter anderem:
- Stentimplantation oder intraluminale Thermoablation
- palliative Polychemotherapie
- Trastuzumab-Antikörpertherapie bei HER2-Exprimierung
- palliative Brachytherapie
- Analgesie
- Sicherstellung der Nahrungszufuhr
Endoskopische Resektion
Der Begriff der endoskopischen Resektion (ER) beinhaltet sowohl die endoskopische Mukosaresektion (EMR) mittels Saug- und Schneidetechnik sowie die endoskopische Submukosadissektion (ESD).
Die EMR hat sich in vielen westlichen Ländern als Standardtherapieverfahren für HGIEN und mukosale Adenokarzinome etabliert.
Sie ist bei Nachweis einer hochgradigen intraepithelialen Neoplasie oder eines mukosalen Karzinoms im Tumorstadium bis T1, N0, M0 indiziert, sofern die zusätzlichen Kriterien der endoskopischen Resektabilität erfüllt sind.
Bei größeren Läsionen ist die ESD der EMR überlegen. Bessere Ergebnisse bezüglich einer R0-Resektion und Lokalrezidiven erzielt die ESD speziell bei Plattenepithelkarzinomen.
Bei Nachweis einer hochgradigen intraepithelialen Neoplasie oder eines mukosalen Karzinoms (L0, V0, keine Ulzerationen, Grading G1/G2, Infiltrationstiefe m1/m2) im Plattenepithel sollte eine endoskopische en-bloc-Resektion angestrebt werden. So ist neben der Therapie auch ein Staging der Läsion hinsichtlich der Tiefeninfiltration gewährleistet.
Plattenepithelkarzinome
Kriterien zugunsten einer endoskopischen Resektion bei Ösophagus-Plattenepithelkarzinomen:
- Grading ≤ G2
- keine Invasion von Lymphgefäßen (L0) und/oder Venen (V0)
- keine Ulzeration
Adenokarzinome
Kriterien zugunsten einer endoskopischen Resektion bei Ösophagus-Adenokarzinomen:
- Tiefeninvasion < 500 µm
- Durchmesser der Raumforderung < 20 mm
- L0 und/oder V0
- tumorfreier basaler bzw. lateraler Resektionsrand
- keine Ulzeration, keine höhere Differenzierung (G1/G2)
Im Anschluss an eine erfolgreiche Neoplasie-Resektion im Barrett-Ösophagus sollte die verbliebene nicht-neoplastische Barrett-Mukosa thermisch abladiert werden. So wird das Risiko weiterer metachroner Neoplasien reduziert. Gängige Methoden sind die:
- Radio-Frequenz-Ablation (RFA), vor allem beim Long-Segment-Barrett-Ösophagus
- APC-Ablation (Argon-Plasma-Coagulation), vor allem beim Short-Segment-Barrett-Ösophagus
Vorgehen bei Lokalrezidiv
Ein auf die Mukosa beschränktes Lokalrezidiv (crT1a cN0 cM0) nach einer endoskopischen Resektion eines mukosalen Karzinoms im Barrett-Ösophagus kann erneut endoskopisch behandelt werden. Sollte damit keine R0-Resektion zu erzielen sein, ist ein chirurgisches Verfahren besser geeignet.
Nachsorge
Nach einer erfolgreichen endoskopischen Intervention einer hochgradigen intraepithelialen Neoplasie oder eines Frühkarzinoms sind regelmäßige Kontroll-Endoskopien empfohlen; zunächst nach drei Monaten, dann für zwei Jahre alle sechs Monate und danach im jährlichen Abstand.
Chirurgische Therapie
Mit Ausnahme von rein auf die Mukosa begrenzten Karzinomen (T1a, N0, M0), die endoskopisch komplett R0 reseziert werden können, ist die chirurgische Resektion mit kurativer Intention das Standardverfahren für alle potenziell resektablen Ösophaguskarzinome im mittleren und distalen Speiseröhrendrittel. Um eine R0-Resektion zu erreichen, muss ein Sicherheitsabstand nach proximal und distal von je 3 bis 4 cm eingehalten werden.
Eine Operation ist immer dann zu erwägen, wenn einer der folgenden Punkte vorliegt:
- Lymph (L1)- oder Veneninvasion (V1)
- Schlechter Differenzierungsgrad (≥ G3)
- tiefe Submukosainfiltration (≥ 500 μm)
Die operative Therapie sollte in Kliniken mit hoher Fallzahl durchgeführt werden. Ziel der chirurgischen Resektion bei Plattenepithel- und Adenokarzinomen ist die vollständige Entfernung des Tumors und der regionären Lymphknoten. Nach Möglichkeit sind minimal-invasive Verfahren gegenüber offen-chirurgischen Interventionen zu bevorzugen.
Die chirurgische Therapie ist indiziert im:
- Tumorstadium T2
- Tumorstadien T3 und T4 oder bei N+, M0 nach neoadjuvanter Chemotherapie (Adenokarzinom) bzw. Radiochemotherapie (Plattenepithelkarzinom), sofern Operabilität und Resektabilität gegeben sind
Operationsmethode
Die Wahl der Operationsmethode richtet sich nach der Tumorlokalisation:
- Karzinome im distalen und mittleren thorakalen Speiseröhrenabschnitt (inkl. AEG Siewert Typ I): transthorakale subtotale Ösophagektomie mit Resektion des proximalen Magens, Magenhochzug und intrathorakaler Anastomose
- Karzinome im ösophagogastralen Übergang Siewert Typ II: totale Gastrektomie mit distaler Ösophagusresektion oder transthorakale subtotale Ösophagektomie; alternativ transhiatale abdomino-zervikale subtotale Ösophagektomie
- Karzinome des ösophagogastralen Übergangs Siewert Typ III: totale erweiterte Gastrektomie mit distaler Ösophagusresektion. Bei fortgeschrittener Infiltration ggf. Ösophagogastrektomie
- Karzinome im oberen thorakalen Speiseröhrenabschnitt: subtotale Ösophagektomie mit Ausweitung des Sicherheitsabstands nach oral
- thorakale Plattenepithelkarzinome: transthorakale Ösophagusdissektion
- Plattenepithelkarzinome im zervikalen Ösophagus: Operation gegenüber Radiochemotherapie sorgfältig abwägen; bei chirurgischem Vorgehen totale Ösophagektomie oder zervikale Ösophagusresektion über einen zervikalen Zugang mit oberer Sternotomie, Rekonstruktion durch freies Jejunuminterponat
Während der Operation werden die regionären Lymphknoten mit entfernt. Das Ausmaß richtet sich nach der Lokalisation des Primärtumors. Bei der Lymphadenektomie werden drei Felder unterschieden: abdominal, thorakal und zervikal. Standard ist die Zweifeld-Lymphadenektomie.
Rekonstruktion
Resektion und Rekonstruktion sollten nach Möglichkeit einzeitig erfolgen. Bei Patienten mit eingeschränkter funktioneller Belastbarkeit oder fraglicher Vaskularisation des vorbereiteten Mageninterponats kann eine zweizeitige Rekonstruktion sinnvoll sein.
Methode der Wahl nach einer subtotalen Ösophagektomie ist der Magenhochzug. Als Verfahren der zweiten Wahl steht die Koloninterposition zur Verfügung, insbesondere bei Patienten nach Voroperationen am Magen. Bei sehr günstiger Gefäßanatomie kann das Jejunum als Interponat eingesetzt werden.
Nach einer totalen Gastrektomie mit distaler Ösophagusresektion wird die Kontinuität üblicherweise mit einer Roux-Y-Jejunumschlinge und einer End-zu-Seit-Ösophagojejunostomie transhiatal im unteren Mediastinum wiederhergestellt.
Vorgehen bei Fernmetastasen
Bei Vorliegen von Fernmetastasen bringt die Ösophagektomie und gleichzeitige Resektion keinen prognostischen Vorteil. Daher wird bei präoperativer M1-Situation von einer Ösophagektomie abgeraten.
Bei intraoperativer Detektion einer vorher nicht bekannten, sehr limitierten Fernmetastase (Lunge oder Leber), kann diese zusammen mit dem Primärtumor entfernt werden.
Vorgehen bei Lokalrezidiv
Bei einem isolierten Lokalrezidiv nach kurativ intendierter Operation sollte auf einer interdisziplinären Tumorkonferenz über eine erneute Operabilität und Resektabilität – alternativ über eine Radiochemotherapie – diskutiert werden. Die Radiochemotherapie ist eine Option für isolierte Lokalrezidive oder Lymphknotenmetastasen von Plattenepithelkarzinomen des Ösophagus, sofern keine prä- oder postoperative Bestrahlung im Rezidivareal erfolgt ist und eine ausreichende Normalgewebetoleranz vorliegt. Bei isolierten Lokalrezidiven von Ösophagusadenokarzinomen ist ebenso eine Radiochemotherapie denkbar.
Ernährungsmedizin
Die ernährungsmedizinische Versorgung von Patienten mit Ösophaguskarzinomen stellt einen integralen Bestandteil der onkologischen Behandlung dar. Der Einfluss des Ernährungsstatus auf die postoperative Komplikationsrate ist ausführlich beschrieben.
Eine Ernährungsberatung ist während einer neoadjuvanten Therapie – unabhängig vom Ernährungsstatus – empfohlen.
Patienten mit ausgeprägter Mangelernährung und hohem metabolischen Risiko sollen präoperativ eine Ernährungstherapie erhalten, selbst wenn die Operation verschoben werden muss. Die Einnahme einer oralen Trinknahrung hilft, den Energiebedarf zu decken und sollte allen Patienten – unabhängig vom Ernährungsstatus – empfohlen werden.
Nach einer Ösophagusresektion ist es aufgrund des metabolischen Risikos sinnvoll, innerhalb von 24 Stunden mit der enteralen Ernährung zu beginnen. Eine parenterale Supplementierung kann angezeigt sein, wenn postoperativ weniger als 60 bis 75 Prozent der Energiemenge auf enteralem Weg zugeführt werden kann.
In den ersten postoperativen sechs Monaten sollte der Ernährungsstatus (einschließlich Diätberatung) verlaufskontrolliert werden. Die Supplementierung der oralen Energiezufuhr mit Trinklösung oder Sondenernährung über eine zunächst belassene Feinnadelkatheterjejunostomie (FKJ) kann zuweilen angeraten sein. Wenn erforderlich, ist eine Unterstützung über die FKJ (zum Beispiel mit 500–1000 kcal/Tag) für mehrere Monate möglich.
Neoadjuvante Therapie
Abhängig vom Ausmaß der Raumforderung kann eine neoadjuvante Therapie in Form von prä- und perioperativen (Radio-) Chemotherapien indiziert sein. Die aktuelle Leitlinie empfiehlt vor Beginn dieser potenziell belastenden Behandlung, den zu erwartenden Nutzen gegenüber den möglichen Risiken abzuwägen. Deshalb sieht sie eine Risikoanalyse wichtiger Organfunktionen und ein Screening auf Mangelernährung vor.
Perioperative Chemotherapie
Eine perioperative Chemotherapie (Kombination aus neoadjuvanter Chemotherapie in kurativer Intention) kann bei fortgeschrittenen Karzinomen ein Down-Staging vermitteln und so die Resektionsmöglichkeiten verbessern.
Indikationen/Kontraindikationen:
- operables Adenokarzinom und AEG der Kategorie T2: relative Indikation zur prä- und postoperativen Chemotherapie („kann“)
- operables Adenokarzinom, AEG der Kategorie T3 und resektabler T4-Tumor; alternativ präoperative Radiochemotherapie
- Plattenepithelkarzinome: nicht empfohlen (kein Überlebensvorteil im Vergleich zur alleinigen Operation)
Das Standardvorgehen bei perioperativer Chemotherapie ist das FLOT-Schema mit einer Kombination aus Docetaxel, Oxaliplatin und 5-Fluorouracil (5-FU).
Nach abgeschlossener präoperativer Chemotherapie müssen vor der erneuten OP-Planung Fernmetastasen ausgeschlossen und der Lokalbefund neu bewertet werden.
Bei Anzeichen für ein fortschreitendes Tumorwachstum während der perioperativen Behandlung sind symptombezogene Diagnostikmaßnahmen erforderlich. Bei Nachweis (bildgebend und/oder endoskopisch) einer Regression der Tumorlast sollte zeitnah operiert werden.
Präoperative Radiochemotherapie
Eine neoadjuvante Radiochemotherapie (Kombination aus neoadjuvanter Chemotherapie und Bestrahlung) verkleinert den Tumor und erhöht bei der nachfolgenden Operation die Wahrscheinlichkeit einer R0-Resektion. Ferner verringert sich das Rezidivrisiko und die Überlebenswahrscheinlichkeit des Patienten steigt.
Indikationen/Kontraindikationen:
- operables Plattenepithelkarzinom der Kategorie T2: relative Indikation zur präoperativen Radiochemotherapie mit anschließender kompletter Resektion („kann“)
- operables Plattenepithelkarzinom der Kategorie T3 und resektabler T4 Tumor: präoperative Radiochemotherapie mit anschließender kompletter Resektion („soll“)
- lokalisiertes Adenokarzinom, AEG der Kategorie T3 und resektabler T4 Tumor: Alternativoption zur perioperativen Chemotherapie
Als Therapieregime hat sich folgende Kombination bewährt:
- 5-Fluorouracil (5-FU) und Cisplatin
- Carboplatin/Paclitaxel
- FOLFOX (Oxaliplatin, Folinsäure, 5-FU)
- Radiotherapie mit 40–50 Gy in konventioneller Fraktionierung; 1,8–2,0 Gy pro Fraktion
Nach Abschluss einer präoperativen Therapie sollten ein erneuter Ausschluss von Fernmetastasen und ein Restaging des Lokalbefundes erfolgen. Bei Anzeichen für ein fortschreitendes Tumorwachstum während der präoperativen Therapie ist eine entsprechende Diagnostik erforderlich. Bei Nachweis (bildgebend und/oder endoskopisch) einer Tumorprogression sollte frühzeitig operiert werden.
Definitive Radiochemotherapie
Bei medizinisch nicht operablem Ösophaguskarzinom oder bei Patienten mit potenziell nicht resektablem Tumor (unabhängig von der histologischen Entität) bietet die definitive Radiochemotherapie – sofern keine Fernmetastasen vorliegen – eine kurative Chance. Zudem ist sie eine Option für Patienten, die trotz ausführlicher Information eine Operation ablehnen.
Die definitive Radiochemotherapie stellt eine Alternative zur Operation dar:
- Bei lokalisiertem Plattenepithelkarzinom des zervikalen Ösophagus ist die definitive Radiochemotherapie gegenüber der primären chirurgischen Resektion bevorzugt zu wählen. („soll“)
- Bei resektablem Plattenepithelkarzinom des intrathorakalen Ösophagus der Kategorie T3/T4 kann die definitive Radiochemotherapie alternativ zur chirurgischen Resektion durchgeführt werden. („kann“)
Weitere Empfehlungen
Gemäß der aktuellen S3-Leitlinie Ösophaguskarzinom gelten weiterhin folgende Empfehlungen:
- Bei histologisch nachgewiesener Tumorpersistenz oder einem isolierten Lokalrezidiv ohne Fernmetastasen nach einer Radiochemotherapie kann eine Salvage-Operation mit kurativem Ziel erwogen werden.
- Bislang gibt es keine klaren Aussagen, dass Antikörper und „small molecules“ das Ergebnis einer präoperativen Therapie verbessern. Daher ist ihr Einsatz außerhalb klinischer Studien nicht indiziert.
- Nach R0-Resektion eines Plattenepithelkarzinoms bringt eine adjuvante Radiotherapie oder Radiochemotherapie keinen signifikanten Überlebensvorteil.
- Nach R0-Resektion eines AEG-Adenokarzinoms kann bei erhöhtem Lokalrezidiv-Risiko eine adjuvante Radiochemotherapie bei nicht neoadjuvant behandelten Patienten versucht werden.
- Eine symptomorientierte Nachsorge sollte grundsätzlicher Therapiebestandteil bei operativ oder radiochemotherapeutisch behandelten Patienten mit Ösophaguskarzinom sein. So können etwaige Funktionsstörungen und Ernährungsprobleme rasch erkannt und behandelt werden.
- Patienten mit Ösophaguskarzinom sollten sich – im Rahmen ihrer Möglichkeiten – körperlich/sportlich betätigen.
- Nach Abschluss der Primärtherapie ist allen rehabilitationsfähigen Patienten eine Anschlussheilbehandlung zu empfehlen. Gemäß individuellem Rehabilitationsbedarf soll die rehabilitative Therapie medizinische, pflegerische, edukative, trainierende und psychosoziale Maßnahmen umfassen.
- Patienten mit Ösophaguskarzinom leiden häufig an Müdigkeit, Depression, Schlafstörungen, ausgeprägter Erschöpfung und körperlich eingeschränkter Leistungsfähigkeit. Ein individuell an die Belastungsfähigkeit angepasstes Ausdauertraining kann Beschwerden des durch die Tumorerkrankung oder therapiebedingten Fatigue-Syndroms reduzieren.
Palliativtherapie
Eine Palliativtherapie ist bei Adeno- und Plattenepithelkarzinomen des Ösophagus indiziert, die aufgrund ihrer Ausdehnung und/oder Fernmetastasierung nicht kurativ behandelt werden können. Palliativtherapeutische Maßnahmen helfen dabei, die Lebensqualität bestmöglich zu erhalten und die Überlebensdauer zu verlängern.
Erstlinientherapie
Bei Patienten mit einem metastasierten oder lokal fortgeschrittenen, nicht kurativ behandelbarem Adenokarzinom der Speiseröhre soll eine palliative Chemotherapie angeboten werden. Dafür wird zunächst der HER2-Status bestimmt.
- Bei negativem HER2-Status wird üblicherweise eine Platin (Oxaliplatin oder Cisplatin)- und Fluoropyrimidin-haltige Zweifachkombination eingesetzt. Diese kann ggf. auf eine Dreifachkombination mit zusätzlich Docetaxel oder Epirubicin erweitert werden
- Bei positivem HER2-Status hat sich die Dreifachkombination aus Cisplatin, einem Fluoropyrimidin und Trastuzumab etabliert
Bei einem metastasierten oder lokal fortgeschrittenen, nicht kurativ behandelbaren Plattenepithelkarzinom der Speiseröhre kann eine palliative systemische Kombinationschemotherapie aus Cisplatin und einem Fluoropyrimidin angeboten werden. Ob sich dieses Regime lebensverlängernd auswirkt, ist jedoch noch nicht gesichert.
Neuen Studien zufolge sollten Patienten mit nicht operablen, lokal fortgeschrittenen oder metastasierten Ösophaguskarzinomen in der Erstlinienbehandlung künftig den Checkpointinhibitor Pembrolizumab zusätzlich zu einer platinbasierten Chemotherapie erhalten. Diese Empfehlung basiert auf den Ergebnissen der Phase-3-Studie KEYNOTE-590 (Annals of Oncology, Volume 31 Supplement 4, September 2020), die bei der virtuellen Jahrestagung der European Society for Medical Oncology (ESMO) vorgestellt wurde. Demnach verbessert sich das Gesamtüberleben durch Hinzufügen von Pembrolizumab im Median um 2,6 Monate im Vergleich zur alleinigen Chemotherapie.
Zweitlinientherapie
Bei Patienten mit einem metastasierten oder lokal fortgeschrittenen, nicht kurativ behandelbarem Adenokarzinom des Ösophagus und ausreichendem Allgemeinzustand sollte eine systemische Zweitlinientherapie durchgeführt werden. Das Behandlungsschema richtet sich nach der jeweiligen Vortherapie. Therapieziele sind die Verlängerung der Überlebenszeit und der Zeit bis zur Tumorprogression sowie der Erhalt der Lebensqualität. Zum Einsatz kommen die zytotoxischen Einzelsubstanzen Irinotecan, Paclitaxel und Docetaxel sowie neuerdings der VEGFR2-Antikörper Ramucirumab als Monotherapie (wenige Nebenwirkungen) oder in Kombination mit Paclitaxel (wirksamer).
Bei Plattenepithelkarzinomen des Ösophagus gibt es nur begrenzte Daten, die eine Wirksamkeit einer Zweitlinien-Chemotherapie zeigen. Dennoch kann sie bei einem metastasierten oder lokal fortgeschrittenen, nicht kurativ behandelbaren Plattenepithelkarzinom erwogen werden. Auf eine prinzipielle Wirksamkeit weisen Taxane, Platinderivate, Irinotecan und Mitomycin hin.
Targeted Therapy
Die „Targeted Therapy“ ist insbesondere für Patienten mit einem metastasierten oder lokal fortgeschrittenem, nicht kurativ behandelbarem Adenokarzinom des Ösophagus und des ösophagogastralen Übergangs eine Option. Ein Überlebensvorteil wurde bei HER2-überexprimierenden Tumoren (IHC3+ oder IHC2+ und FISH+) nachgewiesen. Zum Einsatz kommt der Antikörper Trastuzumab in Kombination mit Cisplatin und Fluoropyrimidinen (5-FU oder Capecitabin).
Palliative Radio(chemo)therapie
Die perkutane Radiotherapie des Ösophaguskarzinoms – ggf. in Kombination mit einer simultanen Chemotherapie – kann zur Linderung der Symptome lokaler Komplikationen wie Blutung, Stenose und/oder Kompression im Rahmen der multidisziplinären Betreuung angewandt werden. Als Radiosensitizer haben sich 5-FU oder Mitomycin C bewährt. Eine gute Ansprechrate bei geringer Toxizität wird mit einer normofraktionierten Radiotherapie (50–60 Gy) und simultaner Gabe von 5-FU erreicht.
Endoskopische Stentimplantation
In den letzten Jahren hat sich der Einsatz selbstexpandierender Metallstents (SEMS) zur schnellen Linderung der Dysphagie als Standardtherapie etabliert. Nach der SEMS-Implantation können etwa zwei Drittel der Patienten mit stenosierendem Ösophaguskarzinom initial wieder feste Nahrung zu sich nehmen. Alternativ zur endoskopischen Stentimplantation kommt die Brachytherapie zum Einsatz.
Palliative Brachytherapie
Die palliative Brachytherapie kann die Dysphagie und Lebensqualität von Patienten mit inoperablen Ösophaguskarzinomen verbessern. Im Vergleich zur Stentimplantation tritt die Wirkung später ein, allerdings ist die Brachytherapie der SEMS-Implantation nach drei Monaten überlegen.
Eine Kombination von Stentimplantation und Brachytherapie ist besonders für Patienten mit einer länger projektierten Lebenserwartung geeignet. Hierbei kann die Brachytherapie das Stent-bedingte dysphagiefreie Intervall zeitlich ausdehnen.
Eine zusätzliche perkutane Radiotherapie oder Radiochemotherapie verbessert womöglich die Wirkung der Brachytherapie. Die Entscheidung für eine palliative Brachytherapie und deren Kombination mit einer Stentimplantation oder einer perkutanen Radiochemotherapie sollte in einem multidisziplinären Behandlungsteam abgestimmt werden.
Intraluminale lokale Therapie
Bei Patienten mit exophytischem Ösophaguskarzinom kann im Rahmen eines Palliativkonzepts eine intraluminale thermoablative Tumortherapie erwogen werden. Dafür stehen mehrere Methoden zur Verfügung. Die in Deutschland am häufigsten angewandte Methode ist die Argon-Plasma-Coagulation (APC). Nach der lokalen Tumorablation kann eine additive Brachytherapie oder Radiatio das dysphagiefreie Intervall verlängern.
Psychoonkologie
Ein Ösophaguskarzinom ist in der Regel mit unterschiedlichen psychosozialen Belastungen verbunden. Dazu gehören neben der gestörten psychischen Befindlichkeit eine beeinträchtigte globale Lebensqualität. Diese können als Prädiktoren für eine erhöhte Mortalität angesehen werden. Deshalb sollte die psychoonkologische Versorgung ein integraler Bestandteil der onkologischen Diagnostik, Therapie und Nachsorge sein. Ein psychoonkologisches Screening ist so früh wie möglich anzustreben und in angemessenen Abständen, wenn klinisch indiziert oder bei Veränderung des Erkrankungsstatus, zu wiederholen.
Psychosoziale Hilfen beinhalten folgende Angebote:
- Unterstützung bei der Krankheitsverarbeitung
- Hilfe beim Umgang mit fortbestehenden Funktionsstörungen und weiteren krankheits- oder behandlungsassoziierten Einschränkungen (zum Beispiel wirtschaftliche Schwierigkeiten und Fragen zur Rückkehr ins Erwerbsleben)
- Aufklärung und Information über Therapie, Rehabilitation, Nachsorge und ggf. palliativmedizinischer Versorgung
Psychoonkologische Interventionen sind vor allem bei schweren seelischen Belastungen, Paarkonflikten und psychischen Störungen (insbesondere Depressionen, Anpassungs- und Angststörungen) indiziert. Zum Einsatz kommen psychoedukative und supportive Interventionen sowie Einzel- und Paartherapien. Die Maßnahmen sollten am individuellen Bedarf ausgerichtet sein und sich nach den Wünschen des Patienten richten.