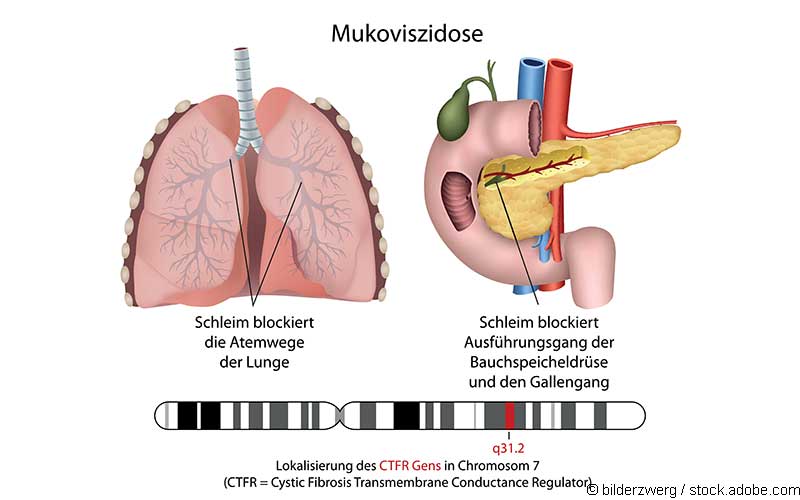
Hintergrund
Die Dreifachkombination Kaftrio des Arzneimittelherstellers Vertex Pharmaceuticals ist seit dem 21. August 2020 in Europa zugelassen. In den USA erhielt das Medikament bereits im Oktober 2011 unter dem Handelsnamen Trikafta die Zulassung. Die drei Wirkstoffe Tezacaftor, Elexacaftor und Ivacaftor wirken am CFTR (Cystic Fibrosis Transmembrane Conductance Regulator)-Kanal, dessen Kanalfunktion bei Mukoviszidose-Patienten genetisch bedingt defekt ist oder nur eingeschränkt funktioniert. In der Folge kommt es zu massiven Störungen des Salz-Wasser-Haushaltes. Kaftrio muss in Europa in Kombination mit Ivacaftor (Kalydeco) verordnet werden. Das Arzneimittel ist ab dem 15. September in Deutschland erhältlich.
Was ist Kaftrio und wofür wird es angewendet?
Kaftrio wird als Kombinationsbehandlung mit Ivacaftor 150 mg angewendet zur Behandlung der zystischen Fibrose (CF) bei Patienten ab 12 Jahren, die homozygot für die F508del-Mutation im CFTR-Gen sind oder heterozygot für die F508del-Mutation im CFTR-Gen und eine Minimalfunktions (MF)-Mutation aufweisen.
Wenn der Genotyp des Patienten nicht bekannt ist, muss das Vorliegen von zwei F508del-Mutationen oder das Vorliegen einer F508del-Mutation und einer Minimalfunktionsmutation mithilfe einer Genotypisierungsmethode bestätigt werden.
Wie wird Kaftrio angewendet?
Kaftrio ist für die orale Anwendung bestimmt und soll zusammen mit einer fetthaltigen Mahlzeit eingenommen werden. Auf grapefruithaltige Speisen oder Getränke ist während der Behandlung mit Kaftrio zu verzichten.
Dosierung
Die empfohlene Dosis beträgt zwei Tabletten (mit jeweils 75 mg Ivacaftor /50 mg Tezacaftor/100 mg Elexacaftor) morgens und eine Tablette Ivacaftor 150 mg abends, die im Abstand von etwa 12 Stunden eingenommen werden.
Wie wirkt Kaftrio?
Kaftrio wirkt als CFTR-Modulator. CFTR ist ein Chloridkanal auf der Zelloberfläche. Wenn das Protein aufgrund einer Mutation falsch gefaltet ist oder fehlt, kommt es zu einer Störung des Salz- und Wasseraustausches, wodurch sich an den Schleimhäuten aufgrund des verminderten Wassergehalts ein zähflüssiger Schleim bildet, der zu einer Schädigung der Lunge, des Verdauungssystems und anderer Organe führt.
Elexacaftor und Tezacaftor sind CFTR-Korrektoren, die an verschiedene Stellen des CFTR-Proteins binden und so eine additive Wirkung auf die zelluläre Verarbeitung und den Transport von F508del-CFTR haben und dadurch die Menge von CFTR-Protein an der Zelloberfläche im Vergleich zu jedem der beiden Wirkstoffe allein erhöhen.
Ivacaftor verstärkt die CFTR-Kanal-Öffnungswahrscheinlichkeit (oder Gating-Aktivität) des CFTR-Proteins auf der Zelloberfläche. Elexacaftor, Tezacaftor und Ivacaftor führen so zu einer Zunahme der Menge und Funktion von F508del-CFTR an der Zelloberfläche, was zu einer erhöhten CFTR-Aktivität führt.
Gegenanzeigen
Kaftrio darf nicht angewendet werden bei Überempfindlichkeit gegen die Wirkstoffe oder einen genannten sonstigen Bestandteile des Arzneimittels.
Nebenwirkungen
Die häufigsten Nebenwirkungen bei Patienten ab 12 Jahren, die Kaftrio in Kombination mit Ivacaftor erhielten, waren:
- Kopfschmerzen (17,3%)
- Diarrhoe (12,9%)
- Infektion der oberen Atemwege (11,9%)
Wechselwirkungen
Bei der Anwendung von Kaftrio kann es mit folgenden Verbindungen zu Wechselwirkungen kommen:
- CYP3A-Induktoren: Da Elexacaftor, Tezacaftor und Ivacaftor Substrate von CYP3A (Ivacaftor ist ein sensitives Substrat von CYP3A) sind, kann die gleichzeitige Anwendung zu einer reduzierten Bioverfügbarkeit und zu einer verminderten Wirksamkeit führen.
- CYP3A-Inhibitoren
- CYP2C9-Substrate: Ivacaftor kann CYP2C9 hemmen; daher wird bei gleichzeitiger Anwendung von Warfarin eine Überwachung der INR (International Normalized Ratio) empfohlen. Andere Arzneimittel, bei denen es zu einem Anstieg der Bioverfügbarkeit kommen kann, sind Glimepirid und Glipizid; bei der Anwendung dieser Arzneimittel ist daher Vorsicht geboten.
- P-gp-Inhibitoren: Die Bioverfügbarkeit des Tezacaftor-Metaboliten M2-TEZ kann durch P-gp-Inhibitoren erhöht werden. Bei der Anwendung von P-gp-Inhibitoren (wie z. B. Ciclosporin) ist daher Vorsicht geboten
- P-gp-Substrate: Bei gleichzeitiger Anwendung von Ivacaftor oder Tezacaftor/Ivacaftor mit Digoxin, einem sensitiven P-gp-Substrat, erhöhte sich die AUC von Digoxin um das 1,3-Fache, was mit einer schwachen Hemmung von P-gp durch Ivacaftor übereinstimmt. Die Anwendung von Kaftrio und Ivacaftor kann die systemische Bioverfügbarkeit von Arzneimitteln, die sensitive Substrate von P-gp sind, erhöhen, wodurch ihre therapeutische Wirkung sowie ihre Nebenwirkungen verstärkt oder länger anhaltend auftreten können. Bei gleichzeitiger Anwendung mit Digoxin oder anderen Substraten von P-gp mit einer geringen therapeutischen Breite, wie z. B. Ciclosporin, Everolimus, Sirolimus und Tacrolimus, ist Vorsicht geboten und es muss eine angemessene Überwachung durchgeführt werden.
- Arzneimittel, die Substrate der Transporter OATP1B1 und OATP1B3 sind: Elexacaftor und M23-ELX hemmen die Aufnahme durch OATP1B1 und OATP1B3 in vitro. Tezacaftor/Ivacaftor erhöhten die AUC von Pitavastatin, einem OATP1B1-Substrat, um das 1,2-Fache. Bei Arzneimitteln, die Substrate dieser Transporter sind, wie z. B. Statine, Glibenclamid/Glyburid, Nateglinid und Repaglinid, kann die gleichzeitige Anwendung mit Kaftrio in Kombination mit Ivacaftor die Bioverfügbarkeit dieser Arzneimittel erhöhen.
- BCRP-Substrate wie z. B. Rosuvastatin: Elexacaftor und Ivacaftor sind BCRP-Inhibitoren. Bei gleichzeitiger Anwendung mit BCRP-Substraten ist eine entsprechende Überwachung erforderlich.
Studienlage
Die Sicherheit und Wirksamkeit von Kaftrio wurde in zwei klinischen Phase-III-Studien (445-102, 445-103) mit über 500 Patienten untersucht. Beide Studien zeigten klinisch signifikante Verbesserungen der Lungenfunktion der Patienten und eine Verringerung der Schweißchloridkonzentration.
In der ersten Studie an Patienten, die heterozygot für F508del mit einer MF-Mutation waren, führte die Behandlung im Vergleich zu Placebo zu einer statistisch signifikanten Verbesserung des ppFEV1 von 14,3 Prozentpunkten (95 % KI: 12,7; 15,8; p<0,0001).
In der zweiten Studie an Patienten, die homozygot für die F508del-Mutation (F/F) waren, führte die Behandlung in Kombination mit Ivacaftor zu einer statistisch signifikanten Verbesserung des ppFEV1 von 10,0 Prozentpunkten (95 % KI: 7,4; 12,6; p<0,0001) im Vergleich zum Tezacaftor/Ivacaftor- und Ivacaftor-Behandlungsregime.



















