Anwendung
Tumornekrosefaktor (TNF)-alpha-Inhibitoren sind biologische Wirkstoffe, die zur Behandlung verschiedener Erkrankungen zugelassen sind wie:
Darüber hinaus werden TNF-alpha-Inhibitoren auch bei einigen Erkrankungen Off-Label angewendet. Erster zugelassener TNF-alpha-Inhibitor war Etanercept zur Behandlung von rheumatoider Arthritis.
Wirkung
Der Tumornekrosefaktor (TNF) spielt eine zentrale Rolle bei der Pathogenese verschiedener entzündlicher Erkrankungen, einschließlich rheumatoider Arthritis (RA). TNF wird intrazellulär, hauptsächlich durch aktivierte Makrophagen gebildet. Die Wirkung von TNF wird durch seine Bindung an die TNF-Rezeptoren I und II (TNFR-I und TNFR-II) vermittelt. TNFR-I ist in den meisten Körpergeweben nachweisbar und für die Mehrzahl der proinflammatorischen Effekte verantwortlich. TNFR-II findet sich dagegen nur auf Endothel-, Immun oder neuronalen Zelle und spielt eine Rolle bei der Zellproliferation, Gewebehomöostase und -regeneration. Ist TNF membrangebunden kann es beide Rezeptortypen aktivieren, während die lösliche Form nur an TNFR-I bindet.
Die Bindung von TNF an TNFR-I und TNFR-II aktiviert mehrere Signalwege, einschließlich Transkriptionsfaktoraktivierung (NF-κB), Proteasen (Caspasen) und Proteinkinasen (c-Jun N-terminale Kinase, MAP-Kinase). Diese Signalgebung führt zur Aktivierung der Zielzelle, was zu einer Entzündungs- und Immunantwort führt, indem mehrere Zytokine freigesetzt und der Apoptoseweg initiiert werden. Somit umfassen die biologischen Wirkungen von TNF die Aktivierung anderer Zellen (Makrophagen, T-Zellen, B-Zellen), die proinflammatorische Zytokinproduktion (IL-1, IL-6), die Chemokinproduktion (IL-8, RANTES), die Expression von Adhäsionsmolekülen (ICAM-1, E-Selectin), Hemmung regulatorischer T-Zellen, Hochregulierung der RANK-Liganden-Expression, Matrix-Metalloproteinase-Produktion und Induktion von Apoptose.
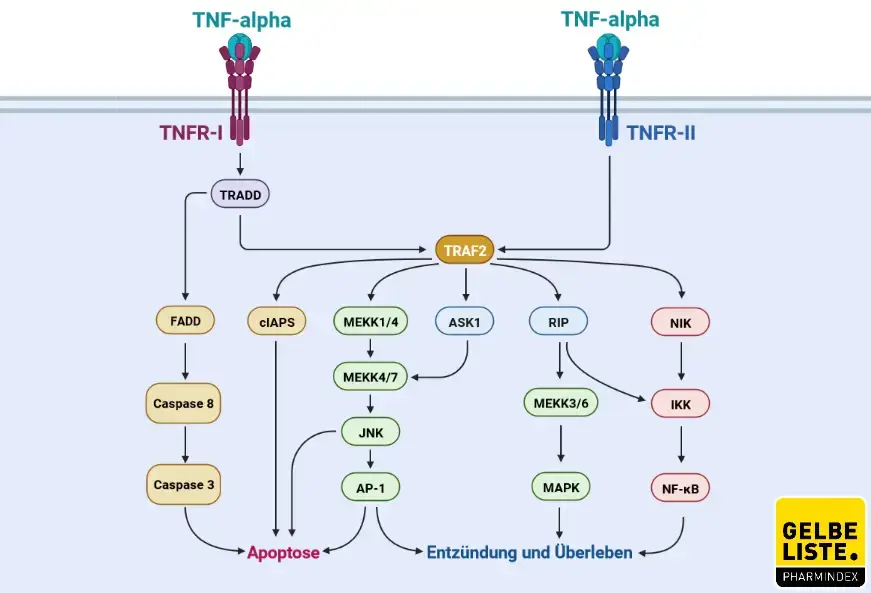
TNF-alpha-Signalweg
Die TNF-alpha-Sekretion kann durch konservierte Strukturelemente induziert werden, die mikrobiellen Pathogenen gemeinsam sind, wie z. B. Lipopolysaccharid (LPS), die von Toll-like-Rezeptoren (TLRs) gebunden werden. TNF-alpha vermittelt seine Wirkung über zwei verschiedene Rezeptoren: TNFR-I (p55 oder p60) und TNFR-II (p75 oder p80).
Die TNFR-I-Ligation induziert die Rezeptortrimerisierung und die Rekrutierung des Adapterproteins TNFR-I-associated death domain protein (TRADD). TRADD rekrutiert den TNF-Rezeptor-assoziierten Faktor (TRAF2) und aktiviert die IκB-Kinase (IKK) durch das Rezeptor-interagierende Protein (RIP). RIP1 wird TRAF2-abhängig während der TNFR-I-Aktivierung ubiquitiniert und ist essenziell für die TNF-alpha-induzierte IKK- und NF-κB-Aktivierung.
TRAF2 rekrutiert schließlich den IKK-Komplex zum aktivierten TNFR-I, indem es mit IKKα und IKKβ interagiert. Der Abbau von IκB setzt den Transkriptionsfaktor NF-κB frei, der in den Zellkern wandert, die κB-Stelle bindet und die Gentranskription aktiviert. NF-κB besteht aus fünf unterschiedlichen, aber strukturell verwandten Untereinheiten, p50, p52, c-Rel, RelA und RelB. Diese Untereinheiten können verschiedene homodimere und heterodimere Komplexe bilden; jede Kombination von Untereinheiten hat eine spezifische Signalfunktion. Diese Untereinheiten sind transkriptionell inaktiv, wenn sie Komplexe mit Proteinen der zytoplasmatischen IκB-Familie bilden.
Zwar ist der TNF-alpha-Signaltransduktionsweg komplex und wurde bisher noch nicht vollständig aufgeklärt, doch kann man festhalten, dass die entzündungsfördernden Wirkungen von TNF-alpha hauptsächlich auf seiner Fähigkeit, NF-κB zu aktivieren beruhen, während die Antitumorwirkungen durch die Aktivierung von Caspase 3 und Induktion von Apoptose hervorgerufen werden. In fast allen Zelltypen wird NF-κB aktiviert, wenn es TNF-alpha ausgesetzt wird und führt zur Expression einer Vielzahl von entzündungsbezogenen Genen. Die vorübergehende Aktivierung von NF-κB als Reaktion auf die Stimulation durch Zytokine induziert dann die Entzündungsreaktion.
Die anhaltende Aktivierung von NF-κB wurde mit mehreren Aspekten der Onkogenese in Verbindung gebracht, wie z. B. der Förderung der Krebszellproliferation, der Verhinderung von Apoptose bei Arzneimittelresistenz und der Erhöhung der Tumorangiogenese sowie Metastasierung.
Nebenwirkungen
TNF-alpha-Inhibitoren werden im Allgemeinen gut vertragen, wobei die häufigen Nebenwirkungen leicht sind und kein Absetzen des Arzneimittels erforderlich machen. Die Medikamente können jedoch auch schwerwiegende Nebenwirkungen verursachen, von denen die häufigsten schwere Infektionen sind.
Zu den häufigen Nebenwirkungen aller TNF-alpha-Inhibitoren (die bei mehr als 10% der Patienten auftreten) gehören:
- Kopfschmerzen
- Reaktionen an der Injektionsstelle bei subkutaner Applikation
- Reaktionen bei der Infusion bei intravenöser Verabreichung
- Hautausschläge
- Anämie
- Erhöhte Transaminasen (normalerweise leicht)
- Infektionen der oberen Atemwege
- Sinusitis
- Husten
- Pharyngitis
- Durchfall
- Übelkeit
- Bauchschmerzen
Kontraindikationen
Patienten sollten keine TNF-alpha-Inhibitoren erhalten, wenn in der Vorgeschichte Überempfindlichkeitsreaktionen auf das jeweilige Präparat aufgetreten sind. Darüber hinaus stellen eine aktive Infektion oder Sepsis eine Kontraindikation dar. Auch bei dekompensierter Herzinsuffizienz der NYHA-Klassen III oder IV dürfen TNF-alpha-Inhibitoren nicht angewendet werden.
Während herkömmliche nicht-biologische DMARDs wie Methotrexat, Leflunomid, Sulfasalazin und Hydroxychloroquin in Kombination mit TNF-alpha-Inhibitoren angewendet werden können, ist die gleichzeitige Anwendung mit einem anderen biologischen Immunsuppressivum kontraindiziert.
Hinweise
Infektionen
Schwerwiegende Infektionen stellen eine signifikante und besorgniserregende Nebenwirkung von TNF-alpha-Inhibitoren dar und umfassen bakterielle, mykotische, virale oder atypische Infektionen. Diese Infektionen können tödlich verlaufen und treten häufiger bei Patienten auf, die mehrere Immunsuppressiva wie etwa Methotrexat oder Kortikosteroide in Kombination erhalten. Es gibt Berichte über die Reaktivierung von Tuberkulose sowie Hepatitis B und Hepatitis C. Es wird deshalb empfohlen, Personen auf bereits vorliegende Erkrankungen hin zu untersuchen, bevor TNF-alpha-Inhibitoren verabreicht werden.
Bei latenter Tuberkulose erfolgt die Reaktivierung innerhalb der ersten Behandlungsmonate mit TNF-alpha-Hemmern. Patienten mit latenter Tuberkulose sollten deshalb eine Behandlung mit Isoniazid oder kombinierten Antituberkulosemitteln erhalten, bevor sie eine Therapie mit TNF-alpha-Hemmern beginnen.
Patienten, die in Gebieten mit einer höheren Inzidenz bestimmter Pilzinfektionen wie Blastomykose, Kokzidioidomykose oder Histoplasmose leben, sollten vor Beginn der Behandlung auf diese Erkrankungen untersucht werden.
Malignome
Theoretisch können TNF-alpha-Inhibitoren die Abwehrmechanismen gegenüber einer Malignität verringern. Eine Analyse der FDA aus dem Jahr 2003 zeigte ein Auftreten von Lymphomen bei 6 von mehr als 6.000 RA-Patienten, die mit TNF-alpha-Inhibitoren behandelt wurden, gegenüber keinem Lymphom-Fall bei den mit Placebo behandelten Patienten. Allerdings ist das Risiko für Lymphome bei RA-Patienten höher (2- bis 3-fach, insbesondere Non-Hodgkin-Lymphom), insbesondere mit zunehmendem Alter und bei Patienten mit einer hohen RA-Erkrankungsaktivität. Mehrere nachfolgende Studien konnten bei RA-Patienten, die mit TNF-alpha-Inhibitoren behandelt wurden im Vergleich zu denen, die DMARDs erhielten, kein erhöhtes Lymphomrisiko feststellen.
Kongestive Herzinsuffizienz
Erste Studien mit TNF-alpha-Inhibitoren bei Patienten mit RA und dekompensierter Herzinsuffizienz NYHA Klasse III oder IV zeigten schlechte kardiale Ergebnisse, einschließlich erhöhter Mortalität, einer Zunahme von Krankenhauseinweisungen und einer Verschlechterung der Herzinsuffizienz..
Es gibt jedoch keine Berichte über eine erhöhte Inzidenz der Entwicklung einer dekompensierten Herzinsuffizienz in Verbindung mit TNF-alpha-Inhibitoren. Ärzte sollten jedoch die Anwendung von TNF-alpha-Inhibitoren bei Patienten mit schwerer dekompensierter Herzinsuffizienz (NYHA-Klasse III oder IV) vermeiden und sie bei Patienten mit leichter dekompensierter Herzinsuffizienz nur mit Vorsicht anwenden.
Lupus erythematodes
Bis zu 50% der Patienten, die mit TNF-alpha-Inhibitoren behandelt werden, entwickeln positive Autoantikörper, einschließlich antinukleäre Antikörper (ANA) und Anti-Ds-DNA-Antikörper. Das Auftreten von arzneimittelinduziertem Lupus ist jedoch selten (weniger als 1%). Die üblichen Manifestationen von arzneimittelinduziertem Lupus durch TNF-alpha-Inhibitoren sind Hautausschlag, Thrombozytopenie, Leukopenie, Hypokomplementämie und selten hämolytische Anämie. Die Symptome klingen normalerweise innerhalb von Wochen bis Monaten nach Absetzen des Medikaments ab, obwohl noch Jahre später Autoantikörper nachgewiesen werden können.
Demyelinisierende Störungen
Es gibt mehrere beschriebene Fälle von demyelinisierenden Erkrankungen, darunter Optikusneuritis, Multiple Sklerose (einschließlich Exazerbation der zugrunde liegenden Multiplen Sklerose), Myelitis, Enzephalitis, Guillain-Barré-Syndrom, transversale Myelitis und chronisch entzündliche demyelinisierende Polyneuropathie bei Patienten, die TNF-alpha-Inhibitoren einnehmen. Aus diesem Grund sollen TNF-alpha-Inhibitoren bei Patienten mit einer zugrunde liegenden demyelinisierenden Erkrankung vermieden oder nur mit äußerster Vorsicht angewendet werden.
Hautreaktionen
Hautausschläge sind unter Anwendung von TNF-alpha-Inhibitoren nicht ungewöhnlich. Die häufigste Form stellen lokale Reaktionen/Erytheme an der Injektionsstelle dar. Doch können auch andere diffuse Hautreaktionen auftreten. So gibt es Berichte über Lupus-ähnliche Hautausschläge, Hypersensitivitäts-Vaskulitis, Urtikaria, neu auftretende Psoriasis, Granuloma anulare, Erythema multiforme und kutanes T-Zell-Lymphom.
Schwangerschaft und Stillzeit
Es wurden keine kontrollierten Studien zur Bewertung der Sicherheit von TNF-alpha-Inhibitoren in der Schwangerschaft oder Stillzeit durchgeführt. Mehrere Register haben ein niedriges Risiko für schwere angeborene Defekte bei der Verwendung von TNF-alpha-Inhibitoren in der Schwangerschaft gezeigt, jedoch nicht signifikant höher in der krankheitsangepassten Vergleichskohorte und ohne Geburtsfehlermuster. Die Forscher beobachteten in Tierversuchen keine fötalen Schäden oder Missbildungen. Mit Ausnahme von Certolizumab passieren alle anderen TNF-alpha-Inhibitoren die Plazentaschranke. Die Anwendung in der Schwangerschaft sollte nur in Betracht gezogen werden, wenn eine klare und starke Indikation vorliegt.
Ebenso liegen keine Daten zur Anwendung von TNF-alpha-Inhibitoren bei stillenden Frauen vor. TNF-alpha-Inhibitoren wurden in der Muttermilch zu weniger als 1% der mütterlichen Serumkonzentration gefunden. Es gibt keine Berichte über Nebenwirkungen bei gestillten Säuglingen oder Effekte auf die Milchproduktion. Bis weitere Daten verfügbar sind, sollte der Einsatz von TNF-alpha-Inhibitoren bei stillenden Frauen vermieden werden.