Was ist Cibinqo und wofür wird es angewendet?
Cibinqo von Pfizer enthält den Januskinase-Inhibitor Abrocitinib, der zur oralen Behandlung von mittelschwerer bis schwerer atopischer Dermatitis bei Erwachsenen indiziert ist, die für eine systemische Therapie infrage kommen.
Wie wird Cibinqo angewendet?
Cibinqo ist zur oralen Anwendung bestimmt und soll einmal täglich unabhängig von den Mahlzeiten ungefähr zur selben Tageszeit eingenommen werden. Die Einnahme zusammen mit einer Mahzeit kann eine Übelkeit verringern.
Dosierung
- Die empfohlene Anfangsdosis von Cibinqo beträgt 200 mg einmal täglich.
- Eine Anfangsdosis von 100 mg einmal täglich wird bei Patienten ab einem Alter von 65 Jahren empfohlen.
- Während der Behandlung kann die Dosis je nach Verträglichkeit und Wirksamkeit verringert oder erhöht werden.
- Es sollte die niedrigste wirksame Dosis für die Erhaltungstherapie in Betracht gezogen werden. Die Tageshöchstdosis beträgt 200 mg.
Wie wirkt Cibinqo?
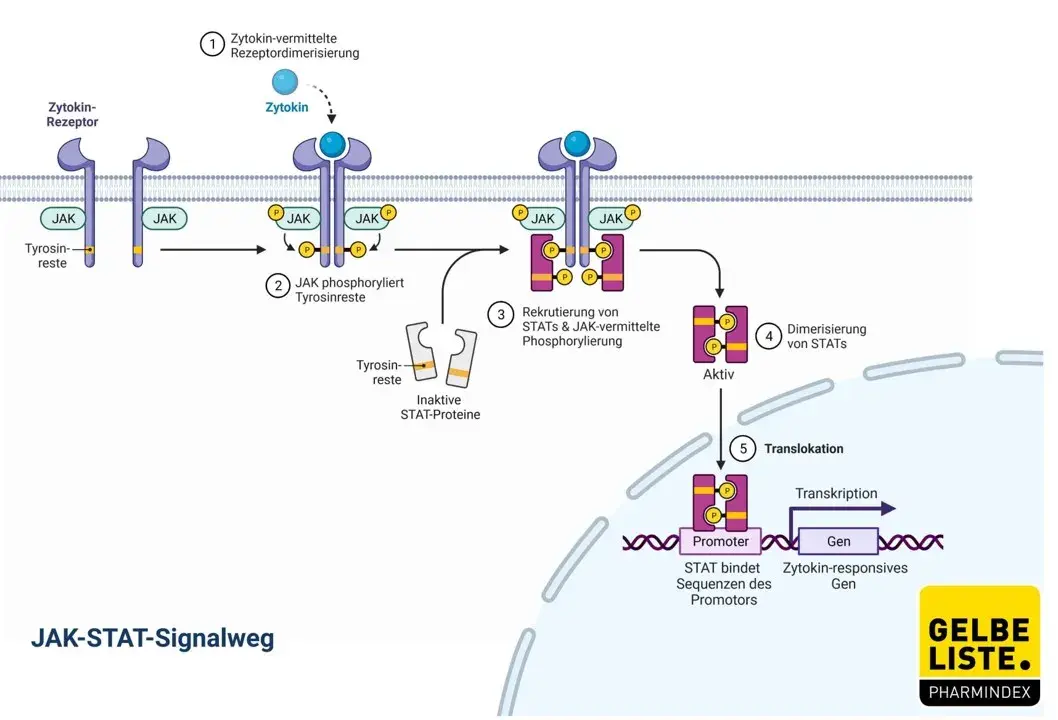
Abrocitinib ist ein oraler JAK1-selektiver Inhibitor, der mehrere wichtige Zytokin-Signalwege hemmt, von denen bekannt ist, dass sie eine wichtige Rolle bei den pathophysiologischen Eigenschaften der Neurodermitis spielen, darunter IL-4, IL-13, IL-31 und Interferon-γ.
Die Familie der Januskinasen (JAK) ist eine Gruppe von zytoplasmatischen Tyrosinkinasen, die Signalwege vermitteln, die durch verschiedene Zytokine aktiviert werden. Über die Beeinflussung des JAK-STAT-Signalwegs ist JAK1 an zahlreichen Vorgängen der Zellproliferation und -differenzierung beteiligt. JAKs phosphorylieren und aktivieren Signaltransduktoren und Aktivatoren der Transkription (STATs), die wiederum die intrazelluläre Aktivität, einschließlich der Genexpression, modulieren. Durch die Hemmung von JAK1 werden diese Signalwege moduliert, indem die Phosphorylierung und Aktivierung von STATs verhindert wird.
Gegenanzeigen
Cibinqo darf weder in der Schwangerschaft noch in der Stillzeit angewendet werden. Darüber hinaus darf Abrocitinib nicht eingenommen werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile
- aktiven, schwerwiegenden systemischen Infektionen, einschließlich Tuberkulose
- schweren Leberfunktionsstörungen
Nebenwirkungen
Die am häufigsten unter der Therapie mit Cibinqo gemeldeten Nebenwirkungen sind:
- Übelkeit (15,1%)
- Kopfschmerzen (7,9%)
- Akne (4,8%)
- Herpes simplex (4,2%)
- Kreatinphosphokinase im Blut erhöht (3,8%)
- Erbrechen (3,5%)
- Schwindelgefühl und (3,4%)
- Schmerzen Oberbauch (2,2%)
Die häufigsten schwerwiegenden Nebenwirkungen sind Infektionen (0,3%), weshalb Patienten während und nach der Behandlung mit Abrocitinib engmaschig auf Anzeichen und Symptome einer Infektion überwacht werden sollen.
Wechselwirkungen
Bei der Therapie mit Cibinqo sind folgende Wechselwirkungen zu beachten:
Mögliche Beeinflussung von Abrocitinib durch andere Arzneimittel
- Abrocitinib wird vorwiegend über die Enzyme CYP2C19 und CYP2C9 und in geringerem Maße über die Enzyme CYP3A4 und CYP2B6 metabolisiert.
- Die aktiven Metaboliten werden über die Nieren ausgeschieden und sind Substrate des organischen Anionentransporters 3 (OAT3).
- Arzneimittel, die Inhibitoren oder Induktoren dieser Enzyme und Transporter sind, könnten sich deshalb auf die Exposition gegenüber Abrocitinib und/oder seinen aktiven Metaboliten auswirken.
Gleichzeitige Anwendung mit CYP2C19/CYP2C9-Inhibitoren
- Wenn Abrocitinib zusammen mit Fluvoxamin (einem starken CYP2C19- und mittelstarken CYP3A-Inhibitor) oder Fluconazol (einem starken CYP2C19- und mittelstarken CYP2C9- und CYP3A-Inhibitor) gegeben wurde, erhöhte sich die Abrocitinib-Wirkstoffexposition um jeweils 91% bzw. 155% im Vergleich zu einer alleinigen Gabe
Gleichzeitige Anwendung mit CYP2C19/CYP2C9-Induktoren
- Eine Anwendung von 200 mg Abrocitinib nach mehreren Dosen Rifampicin, einem starken Induktor von CYP-Enzymen, führte zu einer Verringerung der Abrocitinib-Wirkstoffexposition um etwa 56%
Gleichzeitige Anwendung mit Arzneimitteln, die den pH-Wert im Magen erhöhen
- Die Resorption von Abrocitinib könnte aufgrund der verminderten Löslichkeit von Abrocitinib bei einem pH-Wert über 4 verringert sein.
Mögliche Beeinflussung anderer Arzneimittel durch Abrocitinib
- In vitro ist Abrocitinib ein Inhibitor des P-Glykoproteins (P-gp). Bei einer gleichzeitigen Anwendung von Dabigatranetexilat (ein P-gp-Substrat) mit einer Einzeldosis von 200 mg Abrocitinib erhöhten sich die AUCinf und Cmax von Dabigatran um etwa 53% bzw. 40% im Vergleich zur alleinigen Anwendung.
- Vorsicht ist geboten, da sich die Konzentration von P-gp-Substraten mit engem therapeutischen Index, wie z. B. Digoxin, erhöhen könnte.
- In vitro induziert Abrocitinib die Enzyme CYP2B6 und CYP1A2 und induziert und hemmt die CYP2C19-Enzyme.
- Die Exposition gegenüber Arzneimitteln, die über CYP2B6 (z. B. Bupropion, Efavirenz) und CYP1A2 (z. B. Alosetron, Duloxetin, Ramelteon, Tizanidin) verstoffwechselt werden, kann bei einer gleichzeitigen Anwendung mit Abrocitinib vermindert sein.
- Die Exposition gegenüber Arzneimitteln, die über CYP2C19 metabolisiert werden (z. B. S-Mephenytoin), kann sich zunächst erhöhen und dann verringern bei gleichzeitiger Anwendung von Abrocitinib.
Studienlage
Die Sicherheit und Wirksamkeit von Cibinqo wurde bei 1.616 Patienten in drei randomisierten, placebokontrollierten klinischen Phase-III-Studien mit 12-wöchiger Monotherapie (MONO-1, MONO-2) und 16-wöchiger Kombinationstherapie (COMPARE) untersucht.
Die Wirksamkeit und Sicherheit von Abrocitinib als Monotherapie über 52 Wochen wurden außerdem bei 1.233 Patienten in einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie mit Induktionsphase und randomisierter Absetzphase (REGIMEN) untersucht.
Die Patienten der vier Studien waren 12 Jahre oder älter und hatten eine mittelschwere bis schwere atopische Dermatitis definiert gemäß IGA ≥ 3 (Investigator’s Global Assessment), EASI ≥ 16 (Eczema Area and Severity Index), eine betroffene Körperoberfläche (Body Surface Area, BSA) ≥ 10% und PP-NRS ≥ 4 (Peak Pruritus Numerical Rating Scale) bei Baseline der Studie vor der Randomisierung.
Geeignete Patienten, die den gesamten Behandlungszeitraum einer qualifizierenden Hauptstudie (d. h. MONO-1, MONO-2, COMPARE, REGIMEN) abschlossen, kamen für die Aufnahme in die Langzeit-Erweiterungsstudie EXTEND infrage.
In EXTEND erhielten die Patienten Abrocitinib mit oder ohne wirkstoffhaltige Hintergrundtherapie zur topischen Applikation. Patienten, die zuvor in den Hauptstudien auf 100 mg oder 200 mg des Arzneimittels einmal täglich randomisiert worden waren, erhielten in EXTEND weiterhin die gleiche Dosis wie in der Hauptstudie. In EXTEND erhielten die Patienten bis zum Abschluss der Hauptstudie eine doppelblinde Behandlung. Anschließend war die Behandlung nur noch einfach verblindet.
Ergebnisse
In Woche 12 oder Woche 16 erreichte ein signifikant höherer Anteil an Patienten, die 100 mg oder 200 mg Abrocitinib einmal täglich erhielten, die beiden primären Endpunkte IGA 0 oder 1 und/oder EASI-75 im Vergleich zu den Placebo-Patienten.
Im Vergleich zu Placebo erreichte ein signifikant höherer Anteil an Patienten, die 100 mg oder 200 mg Abrocitinib einmal täglich erhielten, eine Verbesserung um mindestens 4 Punkte auf der PP-NRS. Diese Verbesserung wurde bereits in Woche 2 festgestellt und hielt bis Woche 12 an.
In der COMPARE-Studie wurde die Überlegenheit von 200 mg Abrocitinib im Vergleich zu Dupilumab in Woche 2 für den Anteil der Patienten gezeigt, die mindestens eine Verbesserung um 4 Punkte auf der PP-NRS erreichten, wobei bereits am Tag 4 nach der ersten Dosis ein signifikant höheres Ansprechen des Juckreizes beobachtet wurde.
Eine kontinuierliche Behandlung (kontinuierlich 200 mg) und eine Behandlung mit einer Induktions- und einer Erhaltungstherapie (200 mg für 12 Wochen, gefolgt von 100 mg) verhinderte in der Studie REGIMEN Krankheitsschübe mit einer Wahrscheinlichkeit von 81,1% bzw. 57,4%, im Vergleich zu 19,1% bei Patienten, bei denen die Behandlung nach einer 12-wöchigen Induktionssphase beendet wurde (Randomisierung auf Placebo).
351 Patienten, darunter 16,2% mit 200 mg, 39,2% mit 100 mg und 76,4% mit Placebo, erhielten eine Notfallbehandlung mit 200 mg Abrocitinib in Kombination mit einer topischen Therapie.
Von den Patienten, die nach 12 Wochen Behandlung ein Ansprechen erreichten und in EXTEND eingeschlossen wurden, bestand für beide Dosierungen von Abrocitinib das Ansprechen bei den meisten Patienten in Woche 48 der kumulativen Behandlung fort (60% bzw. 70% für das IGA-Ansprechen [0 oder 1], 79% bzw. 87% für EASI-75 und 62% bzw. 83% für PP-NRS4 bei 100 mg einmal täglich bzw. bei 200 mg einmal täglich).
Von den Patienten, die nach 12 Wochen Behandlung kein Ansprechen erreicht hatten und in EXTEND eingeschlossen wurden, erreichte ein bestimmter Anteil ein spätes Ansprechen in Woche 24 (ab Baseline) der fortgesetzten Behandlung mit Abrocitinib (25% bzw. 29% für das IGA-Ansprechen [0 oder 1] und 50% bzw. 59% für EASI-75 bei 100 mg einmal täglich bzw. bei 200 mg einmal täglich).
Bei Patienten mit partiellem Ansprechen in Woche 12 bestand eine höhere Wahrscheinlichkeit eines Behandlungsnutzens in Woche 24 als bei Patienten mit gar keinem Ansprechen in Woche 12.
Patienten, die in der COMPARE-Studie Dupilumab erhielten und anschließend in EXTEND eintraten, wurden bei Eintritt in EXTEND auf entweder 100 mg oder 200 mg Abrocitinib einmal täglich randomisiert. Von den Patienten, die nicht auf Dupilumab angesprochen hatten, erreichte ein erheblicher Anteil 12 Wochen nach der Umstellung auf Abrocitinib ein Ansprechen (34% bzw. 47% für das IGA-Ansprechen [0 oder 1] und 68% bzw. 80% für EASI-75 bei 100 mg einmal täglich bzw. bei 200 mg einmal täglich).