Was ist Hepcludex und wofür wird es angewendet?
Hepcludex (Bulevirtid) von Myr Pharmaceuticals ist ein Peptid, dessen Struktur von L-HBsAg, einem Hüllprotein von Hepatitis-B-Viren, abgeleitet ist und der erste zugelassene Wirkstoff zur Behandlung einer chronischen Hepatitis-Delta-Virus (HDV)-Infektion bei erwachsenen Patienten mit kompensierter Lebererkrankung, die im Plasma (oder Serum) positiv auf HDV-RNA getestet wurden. Diese tritt immer zusammen mit Hepatitis B auf, da das Hepatitis-D-Virus nicht in der Lage ist, eine eigene Virushülle herzustellen.
Bisher wurden wurden Patienten mit chronischer Hepatitis-D u.a. off label mit PEG-Interferon-α behandelt.
Wie wird Hepcludex angewendet?
Hepcludex wird als subkutane Injektion angewendet. Patienten, die sich das Arzneimittel selbst applizieren, sind angemessen zu unterweisen, um das Risiko von Reaktionen an der Injektionsstelle zu minimieren. Hepcludex wird bei - 20 Grad Celsius gelagert. Vor der Rekonstitution kann das Arzneimittel bis zu drei Monate im Kühlschrank bei 2 bis 8 Grad Celsius aufbewahrt werden.
Dosierung
Bulevirtid sollte einmal täglich (alle 24 Stunden ± 4 Stunden) in einer Dosierung von 2 mg durch subkutane Injektion als Monotherapie oder in Kombination mit einem Nukleosid-/Nukleotidanalogon zur Behandlung der HBV-Grundinfektion verabreicht werden.
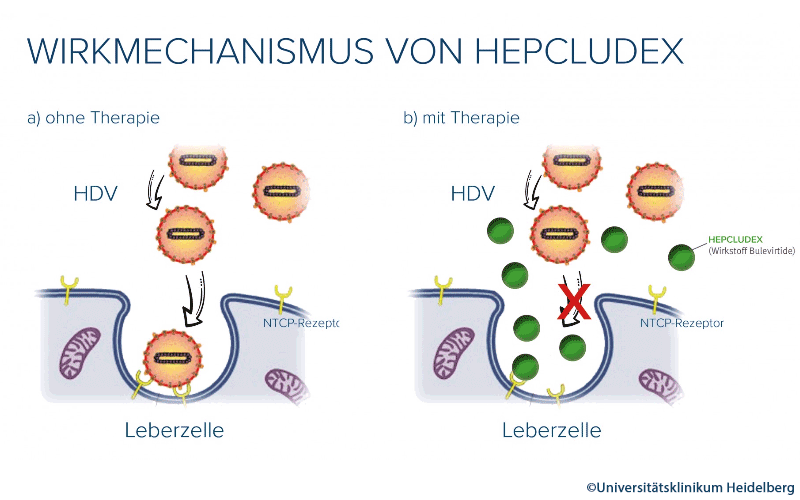
Wie wirkt Hepcludex ?
Bulevirtid blockiert das Eindringen von HBV und HDV in Hepatozyten, indem es die Struktur von L-HBsAg, einem Hüllprotein von Hepatitis-B-Viren imitiert und so an den Natrium-Taurocholat-Cotransporter (NTCP), einen Gallensalz-Transporter der Leber, der als essentieller HBV-/HDV-Eingangsrezeptor fungiert, bindet und diesen inaktiviert. Das Arzneimittel wirkt so nach dem Schlüssel-Schloss-Prinzip: Hepatitis B- und D-Viren vermehren sich ausschließlich in der Leber, denn nur auf den Leberzellen befindet sich der Gallensalztransporter NTCP, welchen sie als „Schloss“ (Virusrezeptor) nutzen, um in die Zellen einzudringen. Hepcludex blockiert wie ein abgebrochener Schlüssel dieses Schloss.
Gegenanzeigen
Hepcludex darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff.
Nebenwirkungen
Die am häufigsten gemeldeten Nebenwirkungen in klinischen Studien waren asymptomatische, dosisabhängige und reversible Erhöhung der Gallensalze (sehr häufig) und Reaktionen an der Injektionsstelle (häufig).
Die am häufigsten gemeldete schwerwiegende Nebenwirkung war eine Exazerbation der Hepatitis nach Absetzen von Bulevirtid, die möglicherweise mit einem Virus-Rebound nach Absetzen der Behandlung im Zusammenhang stand.
Wechselwirkungen
Bei der Therapie mit Hepcludex können bei gleichzeitiger Anwendung folgender Verbindungen Wechselwirkungen auftreten:
- Inhibitoren oder Substrate des Natriumtaurocholat-kotransportierenden Polypeptids (NTCP): In vitro wurde gezeigt, dass bestimmte Arzneimittel das Ziel von Bulevirtid, NTCP, inhibieren können. Die gleichzeitige Anwendung dieser Arzneimittel (z. B. Sulfasalazin, Irbesartan, Ezetimib, Ritonavir und Ciclosporin A) wird nicht empfohlen. Als Vorsichtsmaßnahme ist eine engmaschige klinische Überwachung angezeigt, wenn NTCP-Substrate (z. B. Estron-3-sulfat, Fluvastatin, Atorvastatin, Pitavastatin, Pravastatin, Rosuvastatin und Schilddrüsenhormone) gleichzeitige mit Bulevirtid angewendet werden. Nach Möglichkeit ist die gleichzeitige Anwendung dieser Substrate zu vermeiden.
- Inhibition von OATP1B1/3-Transportern: Als Vorsichtsmaßnahme ist eine engmaschige klinische Überwachung angezeigt, wenn OATP1B1/3-Substrate (z. B. Atorvastatin, Bosentan, Docetaxel, Fexofenadin, Glecaprevir, Glyburid (Glibenclamid), Grazoprevir, Nateglinid, Paclitaxel, Paritaprevir, Pitavastatin, Pravastatin, Repaglinid, Rosuvastatin, Simeprevir, Simvastatin, Olmesartan, Telmisartan, Valsartan, Voxilaprevir) gleichzeitig angewendet werden. Nach Möglichkeit ist die gleichzeitige Anwendung dieser Wirkstoffe zu vermeiden.
- CYP3A4-Substrate mit geringer therapeutischer Breite: Als Vorsichtsmaßnahme ist eine engmaschige klinische Überwachung für gleichzeitig angewendete Arzneimittel mit geringer therapeutischer Breite angezeigt, die empfindliche CYP3A4-Substrate sind (z. B. Ciclosporin, Carbamazepin, Simvastatin, Sirolimus und Tacrolimus).
Studienlage
Die klinische Wirksamkeit und Sicherheit von Bulevirtid wurden in zwei Phase-II-Studien (MYR 202 und MYR 203) an Patienten mit chronischer HDV-Infektion und aktiver Hepatitis untersucht. In der MYR 202-Studie, einer multizentrischen, offenen, randomisierten klinischen Phase-II-Studie wurden drei Bulevirtid-Dosen (2 mg/Tag, 5 mg/Tag und 10 mg/Tag) über einen Zeitraum von 24 Wochen bei Patienten mit chronischer Hepatitis-D mit Leberzirrhose, Patienten, deren vorherige Interferon-Therapie erfolglos war oder Patienten, für die eine solche Therapie kontraindiziert war (einschließlich Interferon-Unverträglichkeit in der Anamnese), untersucht. Die Studienteilnehmer erhielten 24 Wochen lang entweder subkutane Injektionen von Bulevirtid 2 mg/Tag, 5 mg/Tag und 10 mg/Tag zusätzlich zu Tenofovir (Tabletten) oder eine Tenofovir-Monotherapie. 50% der Studienteilnehmer hatten bei Studienbeginn eine Leberzirrhose. Die Teilnehmer hatten eine kompensierte Lebererkrankung, das mittlere Alter betrug 40,2 (9,5) Jahre, 66,9% waren männlich, 85,6% waren Kaukasier, 13,6% Asiaten und 0,8% Schwarze. Die Patienten hatten eine aktive Hepatitis mit mittleren ALT-Konzentrationen von 115 (79,5) U/l. Patienten mit HIV-Infektionen und aktiven HCV-Infektionen waren ausgeschlossen. Die Merkmale zu Studienbeginn waren zwischen den Behandlungsarmen vergleichbar.
In MYR 203 wurden insgesamt 15 Patienten 48 Wochen lang mit 2 mg Bulevirtid täglich behandelt. In diesem begrenzten Datensatz unterschieden sich die Wirksamkeit und Sicherheitsprofile nicht erheblich von denen der Patienten, die 24 Wochen lang behandelt wurden. Bei zwei Teilnehmern trat ein virologischer Durchbruch auf, wahrscheinlich im Zusammenhang mit mangelnder Medikationstreue.
Primärer Endpunkt war eine nicht nachweisbare HDV-RNA-Konzentration oder eine Verringerung um ≥ 2log10 von Studienbeginn bis Woche 24.
Ergebnisse
Den primären Endpunkt erreichten unter Bulevirtid/Tenofovir 55 von 90 Patienten. Unter Tenofovir-Monotherapie wurde der primäre Endpunkt nur von einer Person der 28 Patienten erreicht .