Pathogenese
Die pathophysiologischen Mechanismen, die einem Vorhofflimmern zugrunde liegen, sind bisher nur teilweise entschlüsselt. Als Hauptursache werden elektrophysiologische Anomalien verstanden; weiterhin spielen Veränderungen der kardialen Ionenkanäle und molekulare Störungen eine Rolle [2].
Elektropathologie
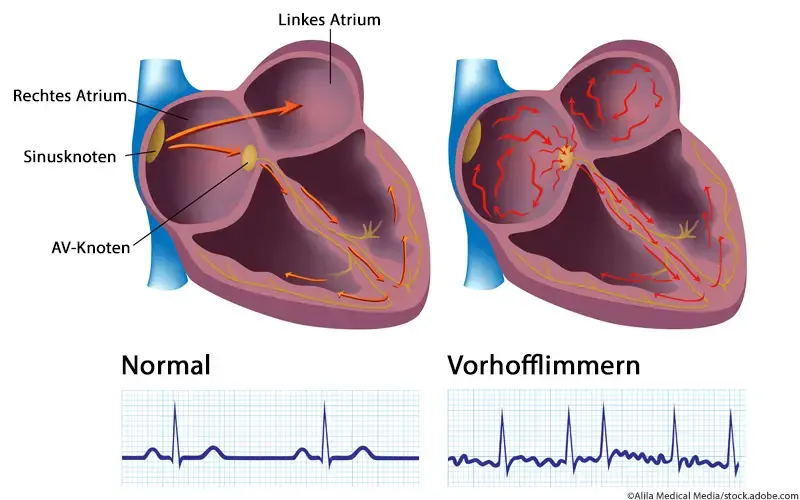
Das allgemeine pathophysiologische Konzept des Vorhofflimmerns geht davon aus, dass Vorhofflimmerparoxysmen hauptsächlich auf ektopische irreguläre Schrittmacheraktivitäten zurückzuführen sind. Darunter werden spontane Depolarisationen des Vorhofgewebes außerhalb des Sinusknotens verstanden. Ausgehend von den ektopischen Aktivitäten entstehen multiple polytope Mikro-Reentry-Kreisläufe, aus denen Vorhoffrequenzen von 350–600 bpm resultieren können.
Ein Teil dieser sich ständig positionell verändernden tachykarden atrialen Impulse werden vom AV-Knoten abgefangen und völlig ungeordnet auf die Ventrikel übergeleitet. Die Vorhofkontraktionen sind nicht mehr synchronisiert, das Schlagvolumen inkonstant und das Herzzeitvolumen sinkt. Es entsteht das Bild einer absoluten Arrhythmie, die wie folgt eingeteilt wird:
- Tachyarrhythmia absoluta: mittlere Kammerfrequenz >100 bpm
- normofrequente absolute Arrhythmie: 60–100 bpm
- Bradyarrhythmia absoluta: <60 bpm [7]
Ektopische Aktivitäten entstehen zu 95% im linken Vorhof im Bereich der Pulmonalvenen; in nur 5% der Fälle stammen sie aus der oberen und unteren Hohlvene (Vena cava superior, Vena cava inferior) [14].
Ein bevorzugter Ort für Überleitungsstörungen ist das Bachmann-Bündel. PatientInnen mit langanhaltendem Vorhofflimmern weisen ausgedehnte Leitungsanomalien entlang der seitlichen Begrenzungen der Vorhofmuskulatur auf. Rezidivierende Flimmerepisoden verursachen im Laufe der Zeit funktionelle und strukturelle Veränderungen im Vorhofgewebe (atriales Remodelling). Diese erhöhen die Anzahl der Flimmerepisoden und verlängern deren Dauer, sodass sich zunehmend ein permanentes Vorhofflimmern ausbildet [2].
Veränderungen der kardialen Ionenkanäle
Vorhofflimmern hängt auch mit Veränderungen im elektrischen Umbau der kardialen Ionenkanäle (wie Ca2+- und K+-Kanäle) zusammen. Diese Abweichungen führen zu einer erhöhten diastolischen Ca2+-Freisetzung aus den Ca2+-Speichern des sarkoplasmatischen Retikulums (SR) und undichten Ca2+-Freisetzungskanälen des Ryanodinrezeptors 2 (RyR2). Daraus resultiert ein verkürztes Aktionspotenzial, wodurch die elektrophysiologische und kontraktile Funktion der Kardiomyozyten beeinträchtigt wird, was wiederum Vorhofflimmern begünstigt [2].
Molekulare Störungen
Vorhofflimmern ist mit anhaltenden strukturellen Schäden in den atrialen Kardiomyozyten, einschließlich des Zusammenbruchs der mitochondrialen, zytoskelettalen und sarkomeren Netzwerke assoziiert. Das geht mit der Bildung von Autophagosomen einher, was auf eine Aktivierung des autophagischen Proteinabbaus und Veränderungen der Chromatinzusammensetzung schließen lässt.
Physiologisch ist die Makroautophagie ein lebenswichtiger zellulärer Prozess. Ein autophagischer Proteinabbau, wie er bei Vorhofflimmern beobachtet wird, führt allerdings zum Abbau des Zytoskeletts, zu einer Beeinträchtigung der Kalziumverarbeitung sowie zu elektrischen und kontraktilen Funktionsstörungen des Vorhofs.
An diesen strukturellen Veränderungen beteiligte molekulare Mechanismen sind zum Beispiel eine gestörte Proteostase (diese umfasst Proteinsynthese, -reifung, -funktion, -transport und -abbau), die Aktivierung von Stresssignalen, eine Genominstabilität und Entzündungssignale [2].
Defekte Proteostase: die Rolle des Protein-Qualitätskontrollsystems
Proteine sind komplexe Makromoleküle, die an der korrekten Funktion aller Zellen, einschließlich der Vorhofkardiomyozyten, beteiligt sind. Um die Integrität des Proteoms aufrechtzuerhalten, wird die Proteostase durch das sogenannte Protein-Qualitätskontrollsystem, das aus mehreren Chaperonen besteht, überwacht. Unter physiologischen Bedingungen werden abgelaufene, irreversibel fehlgefaltete oder geschädigte Proteine aus der Zelle entfernt, um toxische Proteinaggregationen und Fehlfunktionen des Myokards zu verhindern.
Zudem exprimieren Kardiomyozyten hohe Mengen spezifischer kleiner Hitzeschockproteine (HSPs), einschließlich HSP27. Diese lagern sich an kontraktilen Proteinen und dem Mikrotubuli-Netzwerk an und stabilisieren so die Struktur, wodurch die kontraktilen und elektrophysiologischen Funktionen der Kardiomyozyten erhalten bleiben. Bei persistierendem Vorhofflimmern ist die HSP27-Konzentration im Vorhofgewebe vermindert. Niedrige HSP-Spiegel sind somit ein wichtiger Faktor bei der Entstehung und Aufrechterhaltung von Vorhofflimmer-Episoden [2].
Stresssignale
Eine Reihe von Risikofaktoren für Vorhofflimmern, darunter fortgeschrittenes Alter, Herzinsuffizienz, Diabetes mellitus, Alkoholmissbrauch, intra- oder postoperative Vorhofverletzungen und Myokardischämie, führen zu erhöhtem zellulärem Stress. Dieser scheint eine wichtige Rolle bei der Entstehung von Vorhofflimmern zu spielen.
Die Stressreaktion des endoplasmatischen Retikulums (ER) ist ein vorgelagerter Auslöser für den autophagischen Proteinabbau über die so genannte „unfolded protein response“ (UPR). Die UPR induziert die Phosphorylierung des ER/SR-Stresssensors, was die Proteintranslation hemmt und eine gleichzeitige selektive Expression von Transkripten für die Stressreaktion bewirkt. Im Ergebnis werden Autophagosomen stimuliert und der autophagische Proteinabbau aktiviert. Bei Vorhofflimmern stellt die durch ER-Stress ausgelöste (übermäßige) Aktivierung der Autophagie einen wichtigen Mechanismus der Elektropathologie da.
Neben der Rolle der ER-Stress- und UPR-Signalkaskaden sind auch die Stresssignalwege der Mitogen-aktivierten Proteinkinase (MAPK) an der Pathogenese von Vorhofflimmern beteiligt, insbesondere im fortgeschrittenen Alter und bei übermäßigem Alkoholkonsum.
Weiterhin gibt es Hinweise, dass gestresste Herzen aufgrund von Ischämie, Adipositas, Herzinsuffizienz oder Alterung eine verzögerte Erregungsleitung im Vorhof aufweisen, die auf veränderte Na+- oder Gap-Junction-Kanäle zurückzuführen ist [2].
Genominstabilität
Der Erhalt der Integrität des Proteostase-Netzwerks ist ein energieaufwändiger Prozess in den Kardiomyozyten. Vorhofflimmern setzt die Energieproduktionskapazität der Mitochondrien zusätzlich unter Druck, was Mängel in der mitochondrialen Energieproduktion nach sich zieht. Infolge fallen mehr reaktive Sauerstoffspezies (ROS) an, die ein Wegbereiter für oxidative Protein- und DNA-Schäden sind.
Als Reaktion auf diese Schäden wird die DNA-Reparaturmaschinerie ausgelöst, was den Energieverlust verstärkt und die oxidative DNA-Schädigung weiter vorantreibt. Im Ergebnis werden die elektrische Leitfähigkeit, der Kalziumhaushalt, die Ionenkanäle und die kontraktile Funktion beeinträchtigt, wodurch VHF-Episoden initiiert und aufrechterhalten werden können [2].
Inflammationen
Das NLRP3-Inflammasom ist ein Protein-Komplex, der bei der Entstehung von Entzündungen involviert ist und als Reaktion auf Gefahrensignale aktiviert wird. Das können zum Beispiel virale oder bakterielle Pathogene sowie DNA, RNA, ATP und zytosolische Moleküle aus beschädigten Zellen sein. Daraufhin werden Zytokine wie IL-1β und IL-18 freigesetzt, die eine proinflammatorische Antwort vermitteln [2].
Experimentelle Studien haben ergeben, dass das NLRP3-Inflammasom in atrialen Kardiomyozyten deutlich erhöht ist, was zu einer gesteigerten Freisetzung von Ca2+ aus dem sarkoplasmatischen Retikulum führt, somit die elektrische Leitungsfähigkeit beeinträchtigt und Vorhofflimmern begünstigt. Außerdem wurde gezeigt, dass die genetische Unterdrückung von NLRP3 das Risiko für Vorhofflimmern verringern kann [15,16].
Symptome
Vorhofflimmern kann sich auf sehr unterschiedliche Weise äußern. Das Erscheinungsbild reicht von asymptomatischen Verläufen bis hin zu stark ausgeprägten Beschwerden. Die körperliche Belastbarkeit kann ebenfalls variieren. Ältere Menschen neigen eher zu asymptomatischen Episoden als jüngere. Stumme VHF-Episoden werden häufig erst durch eine thromboembolische Komplikation erkannt.
Typische Symptome von Vorhofflimmern sind:
- Palpitationen
- Herzklopfen/Herzstolpern
- Herzrasen
- unregelmäßiger Puls mit Pulsdefizit
- eingeschränkte Belastbarkeit
- Dyspnoe
- Synkope
- Schwindel
- Schweißausbrüche
- Angstgefühle, innere Unruhe
- Müdigkeit
- Schlafstörungen
Viele Menschen mit Vorhofflimmern haben sowohl symptomatische als auch asymptomatische Flimmer-Episoden.
EHRA-Score
Die Schwere der kardiovaskulären Belastung sollte anhand der Symptomskala der European Heart Rhythm Association (EHRA) nach der „modified EHRA classification“ ermittelt werden. Demnach wird die VHF-Symptomatik eingeteilt in [1,17]:
- EHRA-Score 1: VHF verursacht keinerlei Beschwerden
- EHRA-Score 2a: leichte Symptome, die normale Alltagstätigkeit ist durch VHF-bezogene Symptome nicht beeinträchtigt
- EHRA-Score 2b: mittelschwere Symptome, die normale Alltagstätigkeit ist durch VHF-bezogene Symptome nicht beeinträchtigt, aber PatientInnen sind durch die Symptome beunruhigt
- EHRA-Score 3: schwere Symptome, die normale Alltagstätigkeit ist durch VHF-bezogene Symptome beeinträchtigt
- EHRA-Score 4: behindernde Symptomatik, keine normale Alltagstätigkeit mehr möglich
Komplikationen
Vorhofflimmern ist mit einer erhöhten Morbidität und Mortalität assoziiert. Die folgenden Informationen sind der aktuellen ESC-Leitlinie zur Diagnose und Behandlung von Vorhofflimmern entnommen [1]:
Schlaganfall
Eine gefürchtete Komplikation bei Vorhofflimmern ist die Thromboembolie, die zu einem ischämischen Schlaganfall oder Verschlüssen in anderen arteriellen Gefäßprovinzen führen kann.
Kardioembolische Schlaganfälle im Zusammenhang mit Vorhofflimmern verlaufen meist schwer, sind häufig rezidivierend und enden oft tödlich oder münden in einer bleibenden Behinderung. Durch die Etablierung einer leitliniengerechten oralen Antikoagulation (OAK) konnte bei Vorhofflimmern eine absolute Risikoreduktion thromboembolischer Ereignisse um bis zu zwei Drittel erreicht werden, ebenso eine Reduktion der Mortalität.
Linksventrikuläre Dysfunktion und Herzinsuffizienz
Anhaltendes Vorhofflimmern kann in einer linksventrikulären Dysfunktion mit konsekutiver Herzinsuffizienz münden.
Für eine hämodynamische Instabilität sprechen folgende Symptome:
- Synkope
- symptomatische Hypotonie
- akute Herzinsuffizienz
- Lungenödem
- fortbestehende Myokardischämie
- kardiogener Schock
Aufgrund einer ständigen atrialen Überdehnung können Herzklappen-Vitien entstehen, insbesondere eine Mitralklappeninsuffizienz.
Krankenhausaufenthalte
Ungefähr 30% aller VHF-PatientInnen werden jährlich mindestens einmal und 10% zweimal ins Krankenhaus eingewiesen. Die Wahrscheinlichkeit einer Hospitalisierung ist etwa doppelt so hoch wie bei alters- und geschlechtsgleichen Personen ohne Vorhofflimmern (37,5% vs. 17,5%). Die häufigsten Hospitalisierungsgründe von VHF-Betroffenen sind kardiovaskuläre Störungen (49%), nicht kardiovaskuläre Ursachen (43%) und Blutungen (8%).
Lebensqualität (QoL) und funktioneller Status
Mehr als 60% der PatientInnen mit Vorhofflimmern haben eine signifikant eingeschränkte QoL/Belastungstoleranz, bei 17% bestehen behindernde Symptome. Die QoL ist bei Frauen, jungen Menschen und solchen mit Komorbiditäten signifikant niedriger.
PatientInnen mit Vorhofflimmern entwickeln häufiger Angststörungen, sind stärker durch depressive Episoden belastet und haben eine schlechtere QoL mit einem „Distressed“-Persönlichkeitstyp (Typ D). Wichtig ist hierbei, den Zusammenhang zwischen Symptomen und Vorhofflimmern zu erkennen.
Nicht selten werden VHF-assoziierte Beschwerden wie Belastungsschwäche, Müdigkeit oder Konzentrationsabnahme dadurch überdeckt, dass Betroffene ihre Lebensweise entsprechend anpassen. Dieser Umstand ist bei der Symptombewertung zu berücksichtigen.
Kognitive Beeinträchtigung/Demenz
Vorhofflimmern kann zu kognitiver Beeinträchtigung führen, die von einer leichten Funktionsstörung bis zur Demenz reichen kann. Das ist vor allem auf klinisch manifeste oder stumme Schlaganfälle oder unzureichend verstandene schlaganfallunabhängige Mechanismen zurückzuführen.
Studien zur Magnetresonanztomografie (MRT) haben gezeigt, dass Vorhofflimmern mit einer mehr als zweifach erhöhten Wahrscheinlichkeit einer stummen zerebralen Ischämie assoziiert ist.
Sterblichkeit
Vorhofflimmern erhöht das Gesamtmortalitätsrisiko bei Frauen um das 2-fache und bei Männern um das 1,5-fache. Das insgesamte Sterberisiko ist 3,5-fach erhöht. In diesem Zusammenhang spielen vor allem assoziierte Komorbiditäten eine wichtige Rolle.
Zu den häufigsten Todesursachen bei Menschen mit Vorhofflimmern zählen:
Diagnostik
Gemäß der ESC-Leitlinie zur Diagnose und Behandlung von Vorhofflimmern umfasst die VHF-Diagnose eine [1]:
- sorgfältige Anamnese (inklusive aktueller und vergangener Symptomatik, VHF-Muster sowie kardialer und nicht kardialer Begleiterkrankungen)
- klinische Untersuchung (auf Puls- und Blutdruckunregelmäßigkeiten, III. bzw. IV. Herzton und Herzinsuffizienzzeichen wie Beinödeme achten)
- Elektrokardiografie (EKG)
- Echokardiografie
- Labordiagnostik
- ggf. weitere Maßnahmen
EKG
Die Diagnose erfordert eine standardmäßige 12-Kanal-EKG-Aufzeichnung oder eine 1-Kanal-EKG-Ableitung von ≥30 Sekunden mit den elektrokardiografischen Merkmalen des Vorhofflimmerns. Dazu gehören:
- unregelmäßige RR-Intervalle (wenn die atrioventrikuläre Erregungsleitung nicht beeinträchtigt ist)
- Fehlen deutlicher sich wiederholender P-Wellen
- unregelmäßige atriale Aktivierungen
Bei seltenen Episoden sind Langzeit-Überwachungen erforderlich. Hier kommen meist 24-Stunden-Aufzeichnungen zum Einsatz, wobei die Zeitspanne mit modernen Speichermedien verlängert werden kann. Unter die Haut implantierte „Eventrekorder“ können EKG-Daten über mehrere Monate bis Jahre aufnehmen und speichern.
Kardial implantierbare elektronische Devices (CIEDs) können bei entsprechender Programmierung ebenfalls als Ereignisrekorder dienen und sollten regelmäßig auf Anzeichen von VHF und AHRE untersucht werden. Als Grenze für AHRE ist gewöhnlich eine atriale Frequenz von ≥175/min oder ≥180/min eingestellt. Damit beinhalten die Hochfrequenzepisoden Vorhofflimmern, Vorhofflattern sowie atriale Tachykardien.
Echokardiografie
Vervollständigt wird die VHF-Diagnose durch eine nicht invasive kardiologische Diagnostik mittels Belastungs-EKG und transthorakaler Echokardiografie (TTE). Bei der TTE werden der linksatriale Diameter, das Ausmaß der linksventrikulären Hypertrophie (LVH) und die linksventrikuläre Ejektionsfraktion bestimmt.
Labordiagnostik
Internistisch ist der Nachweis oder Ausschluss einer manifesten oder latenten Hyperthyreose mit Schilddrüsenlaborparametern wichtig (TSH, fT3, fT4). Zudem sollten andere Herzkrankheiten und weitere VHF-Risikofaktoren wie Diabetes mellitus und Nierenerkrankungen labordiagnostisch abgeklärt werden.
Ergänzende Maßnahmen
Bei ausgewählten Patientengruppen können ergänzende diagnostische Maßnahmen zum Einsatz kommen, zum Beispiel:
- Bestimmung spezifischer Laborparameter wie hochsensitives kardiales Troponin (cTnT-hs), C-reaktives Protein (CRP), Brain natriuretic Peptide (BNP) und N-terminales pro-brain natriuretisches Peptid (NT-ProBNP)
- transösophageale Echokardiographie (TEE) bei Herzklappenerkrankung und Thrombus im linken Vorhofohr
- computertomografische Koronarangiographie (Koronar-CTA) oder Ischämie-Bildgebung bei Verdacht auf KHK
- kraniales Computertomogramm/Magnetresonanztomogramm (CT/MRT) bei Verdacht auf Schlaganfall
- Late-Gadolinium-Enhancement (LGE) des linken Vorhofs als therapeutische Entscheidungshilfe
Screening
Bei hohem Schlaganfallrisiko bzw. einem Alter über 75 Jahre ist ein systematisches EKG-Screening auf Vorhofflimmern indiziert.
Ein opportunistisches Screening zur Detektion unentdeckter VHF-Verläufe wird ab dem 65. Lebensjahr empfohlen, ebenso bei PatientInnen mit Hypertonie und obstruktivem Schlafapnoesyndrom.
Zudem sollen Menschen mit CIEDs regelmäßig auf asymptomatische AHRE untersucht werden.
Mobile Gesundheitsgeräte
Mittlerweile ist es möglich, sich auch ohne ärztliche Hilfe auf das Vorhandensein von Vorhofflimmern zu screenen. In den letzten Jahren wurden mehrere mobile Wearables mit 1-Kanal-EKG-Applikationen und/oder Pulssensoren eingeführt, die eine frühzeitige Diagnose von VHF erleichtern sollen, darunter Handgeräte, tragbare Patches, Bio-Textilien, Smartphones und Smartwatches.
Die Datengenauigkeit variiert abhängig von Hersteller und Devices. Aufgrund von falsch-positiven Warnmeldungen muss jede potenzielle VHF-Episode, die von mobilen Geräten dokumentiert wird, von einem erfahrenen Arzt/einer erfahrenen Ärztin für die Analyse von Rhythmusregistrierungen überprüft werden. Grundsätzlich aber zeigen die Daten gute Übereinstimmungen.
Therapie
Die Therapie bei Vorhofflimmern sollte idealerweise:
- die Vorhofflimmer-Episoden beseitigen
- den Sinusrhythmus wiederherstellen
- eine atrio-ventrikuläre Synchronie erzielen
- den atrialen Beitrag („atrial kick“) zum Schlagvolumen verbessern
Die Behandlungsoptionen richten sich nach dem Erscheinungsbild. Klare Therapieempfehlungen gibt es beim klinisch diagnostizierten, symptomatischen VHF; beim asymptomatischen, womöglich subklinischen VHF ist die Lage nicht so eindeutig.
Beim Therapiemanagement des symptomatischen Vorhofflimmerns hat sich das ABC-Schema bewährt (Atrial fibrillation Better Care). Das umfasst:
- Antikoagulation zur Prävention von Schlaganfällen und systemischen Embolien
- Besseres Symptommanagement bzw. individuelle, symptomgesteuerte Entscheidungen zur Rhythmus- oder Frequenzkontrolle
- C(K)ardiovaskuläre Risikoreduktion: Optimierung des kardiovaskulären Risikos und Behandlung der Komorbiditäten
CHA2DS2VASc-Score
Die Entscheidung über eine Antikoagulation zur Verhinderung eines Schlaganfalls oder systemischer Embolien ergibt sich aus der Risikostratifizierung mithilfe des CHA2DS2VASc-Scores. Die Punktevergabe erfolgt folgendermaßen [1]:
- Congestive Heart Failure (Herzinsuffizienz): 1 Punkt
- Hypertension: 1 Punkt
- Alter (>75): 2 Punkte
- Diabetes mellitus: 1 Punkt
- Stroke/TIA: 2 Punkte
- Vascular Disease (Gefäßerkrankung): 1 Punkt
- Alter (65–74): 1 Punkt
- Sex category (weibliches Geschlecht): 1 Punkt
Die hypertrophe Kardiomyopathie (HCM) ist an sich schon mit einem erheblichen Schlaganfallrisiko assoziiert und wird standardmäßig über das „C“ mit einem Punkt berücksichtigt.
Menschen mit einem CHA2DS2VASc-Score von 0 Punkten (Männer) oder 1 Punkt (Frauen) haben ein niedriges Schlaganfallrisiko und benötigen in der Regel keine Antikoagulation.
Bei einem CHA2DS2VASc-Score von 1 Punkt (Männer) bzw. 2 Punkten (Frauen) sollte eine Antikoagulation in Erwägung gezogen werden; ab einem CHA2DS2VASc-Score von ≥2 Punkten (Männer) bzw. ≥3 Punkten (Frauen) ist die Antikoagulation empfohlen. Menschen mit niedrigem Schlaganfallrisiko müssen nach 4–6 Monaten erneut evaluiert werden [1].
HAS-BLED-Score
Bei Einleitung einer oralen Antikoagulation (OAK) muss das potenzielle Blutungsrisiko abgeschätzt werden – beispielsweise mithilfe des HAS-BLED-Scores. Hier ergibt sich folgende Punkteverteilung:
- Hypertonie (systolischer Blutdruck >160 mmHg): 1 Punkt
- Abnorme Nieren‑/Leberfunktion (Dialyse, Transplantation, Serumkreatinin >200 μmol/l, Leberzirrhose, Bilirubin mehr als zweimal höher als der obere Grenzwert, AST/ALT/ALP mehr als dreimal höher als der obere Grenzwert): je 1 Punkt
- Stroke (frühere ischämische oder hämorrhagische Schlaganfälle): 1 Punkt
- Blutungsneigung oder -prädisposition (frühere schwere Blutung oder Anämie oder schwere Thrombozytopenie): 1 Punkt
- Labile International Normalized Ratio; INR (TTR <60% bei Antikoagulationstherapie mit Vitamin-K-Antagonisten wie Warfarin): 1 Punkt
- Elderly (Personen >65 Jahre oder extreme Gebrechlichkeit): 1 Punkt
- Drugs (begleitende Einnahme von Thrombozytenaggregationshemmern oder nicht steroidalen Entzündungshemmern [NSAR] und/oder exzessiver Alkoholkonsum): je 1 Punkt
Es ergibt sich folgenden Interpretation:
- 0–2 Punkte: geringes Blutungsrisiko bei OAK
- >2 Punkte: erhöhtes Blutungsrisiko bei OAK
Menschen mit >2 Punkten müssen während einer prophylaktischen Antikoagulation engmaschig überwacht werden, überdies sind Maßnahmen zur Reduktion der Blutungsneigung einzuleiten.
4S-AF-Schema
Die Entscheidung über eine Behandlung zur Rhythmuskontrolle (einschließlich Katheterablation) wird nach dem 4S-AF-Schema getroffen. Bewertet werden folgende Charakteristika:
- Symptomschweregrad (ermittelt nach der EHRA-Symptomskala sowie durch QoL-Fragebögen)
- Schlaganfallrisiko (anhand des CHA2DS2VASc-Scores)
- Schweregrad der VHF-Belastung (spontan terminierend, VHF-Dauer und -Episodendichte pro Zeiteinheit)
- Substratschwere, das heißt die Beurteilung von Begleiterkrankungen/kardiovaskulären Risikofaktoren, Vorhof-Kardiomyopathie, atrialer Vergrößerung, Fehlfunktion und/oder Fibrose (mittels Risikoscores, Bildgebung und Biomarkern)
Die nachfolgenden Empfehlungen entsprechen dem ABC-Schema und sind der aktuellen ESC-Leitlinie zur Diagnose und Behandlung von Vorhofflimmern entnommen [1]:
A wie Antikoagulation/Schlaganfallprävention – NOAKs/DOAKs als Mittel der Wahl
Ist eine Antikoagulation erforderlich, sollen in der Regel direkte orale Antikoagulanzien (DOAKs) – früher auch als neue orale Antikoagulanzien (NOAKs) bezeichnet – gegenüber Vitamin-K-Antagonisten (VKA) bevorzugt werden. Eine Ausnahme bilden PatientInnen mit Vorhofflimmern und mechanischem Herzklappenersatz oder moderater bis schwerer Mitralstenose. In diesen Fällen ist die Antikoagulation mit Vitamin-K-Antagonisten derzeit alternativlos.
In Deutschland sind als DOAKs der direkte Thrombin-Inhibitor Dabigatran sowie die direkten Faktor-Xa-Inhibitoren Apixaban, Edoxaban und Rivaroxaban verfügbar. Eine aktuelle und praxisnahe Zusammenfassung über deren Anwendung bietet die Praxisleitlinie der EHRA aus dem Jahr 2021 [18].
Die Therapieempfehlungen bei Vorhofflimmern basieren auf den Ergebnissen der Phase-III-Studien aller derzeit zugelassenen DOAKs, in denen deren Wirksamkeit und Sicherheit im Vergleich zu VKAs untersucht wurden. In allen Studien (ARISTOTLE zu Apixaban, RE-LY und ENGAGE-AF-TIMI zu Dabigatran und Edoxaban sowie ROCKET-AF zu Rivaroxaban) konnte eine Nichtunterlegenheit gegenüber VKAs nachgewiesen werden. Darüber hinaus bestätigte eine Metaanalyse zu diesen Studien das positive Nutzen-Risiko-Verhältnis der DOAKs im Vergleich zu Warfarin.
In der Zusammenschau war die DOAK-Therapie mit einer signifikanten Reduktion von Schlaganfall und systemischen Embolien (minus 19%) und einer 51%igen Risikoreduktion für einen hämorrhagischen Insult assoziiert. Die Risikoreduktion bezüglich eines ischämischen Schlaganfalls war zwischen VKAs und DOAKs vergleichbar, die Gesamtmortalität unter einer DOAK-Behandlung um 10% verringert. Zudem wurde unter DOAKs eine nicht signifikante Risikoreduktion (minus 14%) für schwere Blutungen beobachtet. Das Risiko für gastrointestinale Blutungen war unter DOAKs hingegen leicht erhöht [20,21].
Hinweis: Die genannten Empfehlungen bezüglich der Antikoagulation beziehen sich auf PatientInnen mit klinischem Vorhofflimmern. Bei subklinischem VHF oder AHRE sind aufgrund einer bisher limitierten Studienlage keine evidenzbasierten Angaben möglich.
Die NOAH-AFNET-6-Studie, die DOAKs bei AHRE-PatientInnen untersuchte, wurde im September 2022 wegen Anzeichen einer fehlenden Wirksamkeit in Verbindung mit erwartbaren Sicherheitsbedenken vorzeitig beendet [22]. Laut ESC-Leitlinie kann der Einsatz einer oralen Antikoagulation bei längerer Dauer von AHRE bzw. subklinischem Vorhofflimmern (≥24 h) und einem geschätzten hohen individuellen Schlaganfallrisiko erwogen werden [1].
Vitamin-K-Antagonisten in Sonderfällen
Ist eine Therapie mit Vitamin-K-Antagonisten indiziert, sollte eine Ziel-INR von 2,0–3,0 mit individuellem TTR ≥70% angestrebt werden. Bei PatientInnen unter VKA mit geringer Zeit im therapeutischen INR-Bereich (zum Beispiel TTR <70%) werden folgende Maßnahmen empfohlen [1]:
- zu einem DOAK wechseln, aber eine gute Adhärenz und Persistenz der Therapie sicherstellen; oder
- um Verbesserung der TTR bemühen (zum Beispiel Aufklärung/Beratung und häufigere INR-Kontrollen)
Thrombozytenaggregationshemmer
Die Gabe von Thrombozytenaggregationshemmern allein (Monotherapie oder ASS in Kombination mit Clopidogrel) wird zur Schlaganfallprävention bei Vorhofflimmern nicht empfohlen.
Vorhofverschluss
Eine Alternative zur Antikoagulation stellt der Vorhofohrverschluss (katheterbasiert oder operativ) dar.
Für den katheterbasierten Vorhofohrverschluss wurde 2021 ein Konsensus-Statement veröffentlicht. Personen, die für diesen Eingriff anstelle einer Antikoagulation infrage kommen, sind demnach PatientInnen [23]:
- bei denen Kontraindikation für eine orale Antikoagulation bestehen (zum Beispiel intrakranielle Blutungen ohne reversible Ursache)
- die nicht langfristig Antikoagulanzien einnehmen möchten
- die ein erhöhtes Blutungsrisiko unter langfristiger oraler Antikoagulation aufweisen
- bei denen medizinischen Störungen gegen eine langfristige orale Antikoagulation sprechen
Zum operativen Vorhofohrverschluss bei Vorhofflimmern liegt die randomisierte LAOS-III-Studie vor, in der PatientInnen im Rahmen sonstiger herzchirurgischer Eingriffe untersucht wurden [24]. Das Risiko von Schlaganfall oder systemischer Embolie war nach einem Vorhofohrverschluss gegenüber der Kontrollgruppe ohne diesen Eingriff signifikant reduziert. Allerdings nahmen die Teilnehmenden in der Mehrzahl auch nach dem Vorhofohrverschluss Antikoagulanzien ein.
Im Ergebnis kann bei PatientInnen mit Vorhofflimmern im Rahmen sonstiger herzchirurgischer Eingriffe ein operativer Vorhofohrverschluss erwogen werden.
B - wie Besserung des Symptommanagements: Frequenz- und Rhythmuskontrolle
Zur Verbesserung von Vorhofflimmern und daraus resultierenden Beschwerden werden zwei Strategien verfolgt: die Frequenz- und Rhythmuskontrolle. In jüngster Zeit gewinnt vor allem die Rhythmuskontrolle zum Erhalt des Sinusrhythmus an Bedeutung, insbesondere bei Menschen, die noch nicht lange an Vorhofflimmern leiden [22,25].
Um den Sinusrhythmus wiederherzustellen und aufrechtzuerhalten ist eine Kombination von Behandlungsansätzen möglich, einschließlich Kardioversion, Antiarrhythmika und Katheterablation, zusammen mit einer adäquaten Frequenz-Regulierung, Antikoagulationstherapie und einer umfassenden kardiovaskulären Prophylaxe.
Kardioversion
Bei hämodynamisch instabilen VHF-PatientInnen kann mit der Notfall-Kardioversion eine akute Rhythmus-Regulierung erreicht werden. Hier ist die elektrische Kardioversion die Methode der Wahl. Bei stabilen PatientInnen kann eine pharmakologische oder elektrische Kardioversion versucht werden. Die pharmakologische Kardioversion ist weniger wirksam, erfordert aber keine Sedierung.
Vor einer geplanten elektrischen Kardioversion ist eine effektive Antikoagulation über mindestens drei Wochen empfohlen, um thromboembolische Komplikationen zu vermeiden. DOAKs werden als mindestens gleich effektiv und sicher wie Vitamin-K-Antagonisten bewertet. Nach der Kardioversion wird eine Antikoagulation für weitere vier Wochen, im Bedarfsfall auch längerfristig, empfohlen [1].
Antiarrhythmika zur Wiederherstellung des Sinusrhythmus sind:
- Flecainid und Propafenon:
o nicht bei ischämischer Herzkrankheit und/oder signifikanter struktureller Herzerkrankung
o können Hypotonie induzieren
o Flecainid kann eine leichte Verbreiterung des QRS-Komplexes verursachen
o Cave: Nicht für die pharmakologische Kardioversion von Vorhofflattern verwenden! - Vernakalant
o sollte nicht bei PatientInnen mit arterieller Hypotonie (SBP < 100 mmHg), kürzlich aufgetretenem ACS (innerhalb eines Monats), Herzinsuffizienz NYHA III oder IV, verlängerter QT-Zeit oder schwerer Aortenstenose angewendet werden
o kann zu arterieller Hypotonie, QT-Verlängerung, QRS-Verbreiterung oder nicht anhaltender ventrikulärer Tachykardie führen - Amiodaron
o kann Phlebitis sowie Hypotonie, Bradykardie/Atrioventrikulären Block, QT-Verlängerung verursachen
o Risiko einer Hyperthyreose - Ibutilid
o wirksam zur Konversion von Vorhofflattern
o nicht bei PatientInnen mit verlängerter QT, schwerer LVH oder niedriger
o LVEF anwenden
o vorzugsweise in der Nähe einer Herzstation verwenden, da es zu QT-Verlängerung und polymorpher ventrikulärer Tachykardie (Torsades de Pointes) führen kann
o EKG-Überwachung für mindestens vier Stunden nach Verabreichung zur Erkennung eines proarrhythmischen Ereignisses
Für die pharmakologische Kardioversion von kürzlich aufgetretenem Vorhofflimmern empfiehlt die Leitlinie Vernakalant i. v. (ausgenommen PatientInnen mit kürzlichem ACS oder schwerer Herzinsuffizienz) oder Flecainid oder Propafenon (ausgenommen PatientInnen mit schwerer struktureller Herzerkrankung).
Intravenöses Amiodaron wird bei Menschen mit Herzinsuffizienz oder struktureller Herzerkrankung empfohlen, wenn eine verzögerte Kardioversion mit der klinischen Situation vereinbar ist.
Eine Kardioversion (entweder elektrisch oder pharmakologisch) sollte bei symptomatischen PatientInnen mit persistierendem Vorhofflimmern als Teil einer rhythmuserhaltenden Therapie erfolgen. Eine pharmakologische Kardioversion ist nur bei hämodynamisch stabilen PatientInnen nach Abwägung des thromboembolischen Risikos indiziert.
Eine Vorbehandlung mit Amiodaron, Flecainid, Ibutilid oder Propafenon kann sinnvoll sein, um den Therapieerfolg einer elektrischen Kardioversion zu erleichtern.
Bei einigen PatientInnen mit seltenem und kürzlich aufgetretenem Vorhofflimmern ohne signifikante strukturelle oder ischämische Herzerkrankung stellt eine einzige selbst verabreichte orale Dosis Flecainid oder Propafenon („Pille in der Tasche“) für eine patientengeführte Kardioversion eine Therapieoption dar, jedoch erst nach einer Bewertung der Wirksamkeit und Sicherheit.
Bei Patienten mit Sick-Sinus-Syndrom, atrioventrikulären Überleitungsstörungen oder verlängerter QTc (>500 ms) wird normalerweise keine pharmakologische Kardioversion empfohlen, es sei denn, die Risiken für Proarrhythmie und Bradykardie wurden berücksichtigt.
Katheterablation
Bei einer Katheterablation werden die Pulmonalvenen vollständig vom linken Atrium isoliert. Die Pulmonalvenenisolation wird entweder durch punktweise Radiofrequenzablation oder durch sogenannte „single-shot“-Ablationsmethoden, insbesondere Kryoablationsverfahren, erreicht. Beide Methoden werden als gleichwertig angesehen [26].
Die Katheterablation wird empfohlen, wenn ein Versuch zur Rhythmusnormalisierung fehlschlägt oder ein Antiarrhythmikum der Klasse I oder III nicht vertragen wird. In bestimmten Fällen kann sie auch als Erstlinientherapie in Betracht gezogen werden.
Dazu gehören Menschen mit symptomatischen paroxysmalen VHF-Episoden oder anhaltendem Vorhofflimmern ohne größere Risikofaktoren für ein erneutes Auftreten des VHF als Alternative zu Antiarrhythmika der Klasse I oder III – jeweils unter Berücksichtigung von Patientenwunsch, Nutzen und Risiko.
Bei VHF-PatientInnen mit Schlaganfallrisikofaktoren, die vor der Ablation keine orale Antikoagulation erhalten, ist diese einzuleiten. Laut Leitlinie sollte präablativ vorzugsweise eine therapeutische OAK über mindestens drei Wochen oder alternativ eine TEE zum Ausschluss eines atrialen Thrombus erfolgen.
PatientInnen, die sich einer Katheterablation unterziehen und die therapeutisch mit VKA, Dabigatran, Rivaroxaban, Apixaban oder Edoxaban antikoaguliert sind, werden ohne OAK-Unterbrechung abladiert.
Nach der Katheterablation bei Vorhofflimmern empfiehlt die Leitlinie, dass
- die systemische Antikoagulation mit Warfarin oder einem DOAK für mindestens zwei Monate nach der Ablation fortgesetzt wird, und
- die Entscheidung über eine langfristige Fortsetzung der systemischen Antikoagulation über zwei Monate nach der Ablation hinaus auf dem individuellen Schlaganfall-Risikoprofil und nicht auf dem offensichtlichen Erfolg oder Misserfolg des Ablationsverfahrens basiert.
Chirurgische VHF-Therapie
Bei PatientInnen, die sich einer Herzoperation unterziehen müssen, sollte eine begleitende Ablation von Vorhofflimmern in Betracht gezogen werden. Dabei sind der Nutzen der Freiheit von Vorhofarrhythmien und die Risikofaktoren für ein Rezidiv (beispielweise linksatriale Dilatation, Alter, Lebensjahre mit Vorhofflimmern, Nierenfunktionsstörungen und andere kardiovaskuläre Erkrankungen) gegeneinander abzuwiegen.
Bei PatientInnen mit symptomatisch paroxysmalem oder persistierendem Vorhofflimmern, die nicht auf eine Antiarrhythmika-Therapie ansprechen und bei denen die perkutane Ablation fehlgeschlagen ist oder offensichtliche Risikofaktoren für ein Versagen der Katheterablation vorliegen, sind thorakoskopische Verfahren (einschließlich Hybrid-Ablationsverfahren) eine mögliche Option, um den Sinusrhythmus langfristig aufrechtzuerhalten. Die Entscheidung muss von einem erfahrenen Team von Elektrophysiologen und Chirurgen unterstützt werden.
Ferner können thorakoskopische Verfahren (einschließlich der chirurgischen Hybridablation) bei PatientInnen mit persistierendem Vorhofflimmern und Rezidiv-Risikofaktoren sinnvoll sein, die trotz mindestens einer fehlgeschlagenen Antiarrhythmika-Therapie symptomatisch bleiben und eine weitere rhythmuserhaltende Therapie bevorzugen.
Eine langfristige orale Antikoagulation wird bei PatientInnen nach einer chirurgischen Ablation von Vorhofflimmern entsprechend dem thromboembolischen Risiko empfohlen – auch, wenn ein Vorhofohrverschluss durchgeführt wurde.
Langfristige Antiarrhythmika-Therapie zum Rhythmus-Erhalt
Ob eine medikamentöse Langzeittherapie mit Antiarrhythmika eingeleitet wird, hängt von der Symptombelastung, möglichen Nebenwirkungen und dem Patientenwunsch ab. Die Arzneimittelauswahl sollte sich primär an Sicherheits- und weniger an Wirksamkeitserwägungen orientieren und wird wesentlich von den patientenindividuellen Komorbiditäten beeinflusst.
Eine langfristige medikamentöse Rhythmuskontrolle mit Flecainid oder Propafenon ist bei PatientInnen mit Vorhofflimmern empfohlen, die eine normale linksventrikuläre Funktion aufweisen und keine strukturellen Herzerkrankungen wie signifikante linksventrikuläre Hypertrophie oder Myokardischämie haben. Bei Flecainid sollte die gleichzeitige Einnahme eines AV-Knoten-blockierenden Wirkstoffs (falls verträglich) erwogen werden.
Für PatientInnen mit Vorhofflimmern und einer normalen oder leicht eingeschränkten, aber stabilen linksventrikulären Funktion, Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF), ischämischer oder valvulärer Herzerkrankung steht Dronedaron zur Verfügung.
Sotalol kann bei PatientInnen mit normaler linksventrikulärer Funktion oder ischämischer Herzerkrankung in Betracht gezogen werden, wobei hier eine sorgfältige Überwachung des QT-Intervalls, des Serumkaliumspiegels, der Kreatinin-Clearance und anderer proarrhythmischen Risikofaktoren erforderlich ist.
Amiodaron kann grundsätzlich bei allen Menschen mit Vorhofflimmern eingesetzt werden, auch bei Herzinsuffizienz mit reduzierter linksventrikulärer Funktion (HFrEF) – ebenfalls unter Überwachung der QT-Zeit. Aufgrund der extrakardialen Toxizität sind aber andere Antiarrhythmika zu bevorzugen.
PatientInnen mit permanentem Vorhofflimmern unter Frequenz-Regulierung und solche mit fortgeschrittenen Erregungsleitungsstörungen sollten keine Antiarrhythmika erhalten – es sei denn, es erfolgt eine antibradykarde Stimulation.
Frequenzkontrolle
Die Frequenzkontrolle stellt eine Behandlungsoption dar, wenn nur geringfügige Symptome bestehen oder eine rhythmuserhaltende Therapie versagt hat. Die Wahl des Arzneimittels hängt von den Begleiterkrankungen ab.
Bei VHF-PatientInnen mit einer linksventrikulären Ejektionsfraktion (LVEF) ≥40% sind Betablocker und die Kalziumantagonisten Diltiazem und Verapamil die Mittel der ersten Wahl. Betablocker und/oder Digitalispräparate (Digoxin/Digitoxin) empfiehlt die Leitlinie bei einer LVEF <40%. Wenn die Ziel-Herzfrequenz mit einer Monotherapie nicht erreicht wird, ist eine Kombinationstherapie mit verschiedenen frequenzregulierenden Arzneimitteln möglich. Bei PatientInnen mit hämodynamischer Instabilität oder stark erniedrigter LVEF kann die Gabe von intravenösem Amiodaron zur akuten Regulierung der Herzfrequenz erwogen werden.
Üblicherweise liegt die Ziel-Herzfrequenz unter 110 Schlägen pro Minute (moderate Frequenz-Regulierung). Im Fall einer Symptompersistenz oder einer sich verschlechternden linksventrikulären Funktion ist eine Herzfrequenz von unter 80 Schlägen pro Minute anzustreben.
Optimierung des kardiovaskulären Risikos und Behandlung der Komorbiditäten
Die ‚C‘-Komponente des ABC-Schemas umfasst die Identifizierung und das Management von interkurrenten Pathologien, kardiometabolischen Risikofaktoren und einer ungesunden Lebensweise. Um die Vorhofflimmerlast und die Schwere der Symptome zu verringern, sind Lebensstiländerungen sowie eine gezielte Behandlung von Begleiterkrankungen wie koronare Herzkrankheit, Bluthochdruck, Diabetes mellitus, Adipositas, Herzinsuffizienz und Schlafapnoe-Syndrom empfohlen.
Konkrete Maßnahmen umfassen beispielsweise:
- eine gute Kontrolle von Blutdruck und Blutzucker
- Gewichtsreduktion bei Adipositas
- körperliche Aktivitätssteigerung (mit Ausnahme von exzessiven Ausdauerübungen)
- Vermeidung von übermäßigem Alkoholkonsum
- Nikotinverzicht
Vorhofflimmern in besonderen Situationen
Vorhofflimmern mit hämodynamischer Instabilität
Bei VHF-PatientInnen mit akuter oder sich verschlechternder hämodynamischer Instabilität wird eine notfallmäßige elektrische Kardioversion empfohlen.
Für die akute Regulierung der Herzfrequenz kann eine Behandlung mit Amiodaron erwogen werden.
Akutes Koronarsyndrom und Vorhofflimmern
PatientInnen mit akutem Koronarsyndrom (ACS) haben ein erhöhtes Risiko für neu auftretendes Vorhofflimmern und umgekehrt. Insgesamt unterziehen sich 10–15% aller Menschen mit Vorhofflimmern einer perkutanen Koronarintervention (PCI). Das kann die antithrombotische Medikation zu einer herausfordernden Situation machen. So gilt es einerseits, ischämischen Komplikationen wie einer Stentthrombose vorzubeugen, andererseits müssen Blutungen verhindert werden.
Die AUGUSTUS-Studie mit mehr als 4.600 VHF-PatientInnen zeigte, dass eine duale antithrombotische Medikation ohne ASS im Vergleich zur Triple-Therapie signifikant sicherer im Hinblick auf schwere Blutungen ist – ohne, dass das Ischämie-Risiko wesentlich ansteigt, allerdings mit einer leicht erhöhten Rate an Stentthrombosen [27].
Sowohl die ESC-Leitlinie zum akuten Koronarsyndrom ohne ST-Streckenhebung (NSTE-ACS) [28] als auch die zur Diagnose und Behandlung von Vorhofflimmern [1] empfehlen eine maximal einwöchige Triple-Therapie mit einem DOAK und zwei Plättchenhemmern (ASS plus Clopidogrel) für die Dauer von einer Woche; danach ist eine duale Therapie aus einem P2Y12-Inhibitor (vorzugsweise Clopidogrel) und einem DOAK für bis zu zwölf Monate anzustreben.
Überwiegt das Blutungsrisiko das thormboembolische Risiko kann die Dauer der dualen Therapie von zwölf auf bis zu sechs Monate reduziert werden. Anschließend ist die alleinige orale Antikoagulation ausreichend.
Wenn das Risiko einer Stentthrombose das Blutungsrisiko überwiegt, sollte erwogen werden, die Triple-Therapie auf bis zu einen Monat zu verlängern.
Akuter Schlaganfall oder intrakranielle Blutung bei Vorhofflimmern
Menschen, die einen akuten ischämischen Schlaganfall oder eine transitorische ischämische Attacke (TIA) erleiden, und bei denen kein Vorhofflimmern bekannt war, sollten auf Vorhofflimmern gescreent werden. Das Screening beinhaltet eine Kurzzeit-EKG-Aufzeichnung von mindestens 24 Stunden Dauer, gefolgt – sofern möglich – von einer kontinuierlichen EKG-Überwachung für mindestens 72 Stunden. In einigen ausgewählten Fällen kann zusätzlich eine EKG-Überwachung mit nicht-invasiven Langzeit-EKG-Monitoren oder implantierbaren Herzmonitoren in Betracht gezogen werden, um VHF-Episoden zu erkennen.
Für Menschen mit bereits bekanntem VHF, die einen ischämischen Schlaganfall oder eine TIA erleiden, empfiehlt die Leitlinie eine langfristige Schlaganfall-Sekundärprävention mit OAKs, sofern keine Kontraindikationen gegen den Einsatz bestehen. Bei DOAK-fähigen PatientInnen sollten diese gegenüber Vitamin-K-Antagonisten bevorzugt verwendet werden.
Eine sehr frühe Antikoagulation (<48 Stunden) mit unfraktioniertem Heparin (UFH), niedermolekularem Heparin (LMWH) oder VKA wird bei VHF-Patienten mit akutem ischämischem Schlaganfall nicht empfohlen.
Bei VHF-PatientInnen mit einem hohen Risiko für einen ischämischen Schlaganfall, sollte in Zusammenarbeit mit einem Neurologen/Schlaganfallspezialisten nach folgenden Ereignissen die (Wieder-)Einführung einer oralen Antikoagulation in Betracht gezogen werden (DOAK gegenüber VKA bevorzugen):
- traumatische, intrakranielle Blutung
- akute spontane intrakranielle Blutung (einschließlich subduraler, subarachnoidaler oder intrazerebraler Blutung) unter Berücksichtigung der Risiken und Vorteile
Aktive Blutungen unter OAK
Bei Menschen mit Vorhofflimmern und einer schweren aktiven Blutung ist die OAK zu unterbrechen, bis die Ursache der Blutung identifiziert und die aktive Blutung behoben wurde. Gleichzeitig sind umgehend spezifische Diagnose- und Behandlungsmaßnahmen einzuleiten, um die Ursache(n) und Quelle(n) der Blutung(en) zu identifizieren und zu behandeln.
Entwickeln VHF-PatientInnen unter einer VKA-Therapie schwere Blutungskomplikationen, sollte der Einsatz von Vier-Faktor-Prothrombinkomplex-Konzentraten erwogen werden.
Herzklappenerkrankung und Vorhofflimmern
Eine orale Antikoagulation sollte bei allen erwachsenen PatientInnen mit intrakardialer Korrektur, Zyanose, Fontan-Palliation oder systemischem rechten Ventrikel sowie mit anamnestischem Vorhofflimmern, Vorhofflattern oder intraatrialen Reentrytachykardie-Episoden erwogen werden.
Für Menschen mit VHF und anderen kongenitalen Herzerkrankungen kann eine Antikoagulation sinnvoll sein, wenn einer oder mehrere nicht geschlechtsspezifische Schlaganfall-Risikofaktoren vorliegen.
Operation zur Behandlung von Vorhofflimmern sind in folgenden Fällen möglich:
- bei PatientInnen, bei denen ein Vorhofseptumdefekt chirurgisch verschlossen werden muss und die eine Vorgeschichte mit symptomatischer Vorhofarrhythmie haben (eine Vorhofablation sollte zum Zeitpunkt des chirurgischen Verschlusses erwogen werden)
- bei PatientInnen mit symptomatischem VHF und einer Indikation zur Korrektur angeborener Herzfehler als Cox-Maze-Operation (in erfahrenen Zentren)
Eine VHF-Katheterablation von atrialen Arrhythmien kann bei kongenitalen Herzvitien in Erwägung gezogen werden, wenn sie in erfahrenen Zentren durchgeführt wird.
Bei angeborener Herzkrankheit kann eine transösophageale Echokardiographie (TEE) zusammen mit einer dreiwöchigen Antikoagulationstherapie vor einer Kardioversion sinnvoll sein.
Postoperatives Vorhofflimmern (POAF)
Vorhofflimmern nach einer Operation (POAF) tritt bei einem signifikanten Prozentsatz von PatientInnen nach kardialen Operationen, nicht kardialen Thorax- und Gefäßeingriffen oder großen kolorektalen Interventionen auf – meist zwischen dem 2. und 4. postoperativen Tag. Viele Episoden sind selbstlimitierend, einige sind asymptomatisch. Allerdings wurde POAF mit einem erhöhten Risiko für rezidivierendes VHF in Zusammenhang gebracht und gilt als Risikofaktor für Schlaganfall, Myokardinfarkt und Mortalität.
Zur Prävention von postoperativem VHF nach herzchirurgischen Eingriffen empfiehlt die Leitlinie perioperative Betablocker oder Amiodaron.
Eine langfristige OAK-Therapie sollte zur Vorbeugung thromboembolischer Ereignisse bei schlaganfallgefährdeten PatientInnen mit postoperativem VHF nach nicht kardialen und herzchirurgischen Eingriffen erwogen werden.