Was ist Paxlovid und wofür wird es angewendet?
Paxlovid (Nirmatrelvir/Ritonavir) ist das erste oral einzunehmende antivirale Arzneimittel, das in der EU zur Behandlung von COVID-19 eine bedingte Marktzulassung erhalten hat. Das Präparat ist indiziert zur Behandlung von COVID-19 bei Erwachsenen, die keinen zusätzlichen Sauerstoff benötigen und bei denen ein erhöhtes Risiko für einen schweren Verlauf der Krankheit besteht.
Wie wird Paxlovid angewendet?
Das Corona-Medikament soll beim ersten Anzeichen einer Infektion oder beim ersten Bewusstsein einer Exposition angewendet werden.
Dosierung
Paxlovid wird in einer Dosis von 300 mg (zwei 150-mg-Tabletten) Nirmatrelvir mit einer 100-mg-Tablette Ritonavir zweimal täglich über fünf Tage angewendet. Eine Packung enthält fünf Blisterpackungen als gemeinsam verpackte Nirmatrelvir-Tabletten mit Ritonavir-Tabletten, die alle erforderlichen Dosen für einen vollständigen fünftägigen Behandlungszyklus bereitstellen.
Wie wirkt Paxlovid?
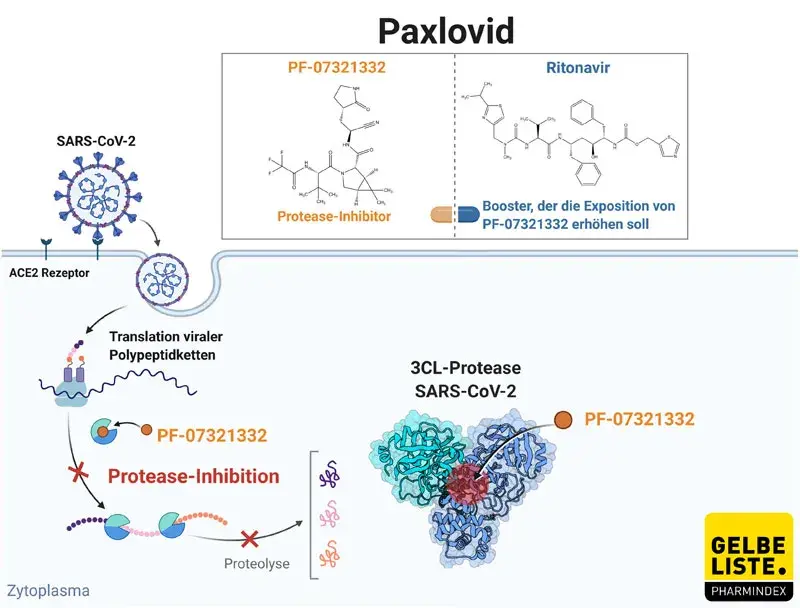
Paxlovid ist eine Kombination der zwei Wirkstoffe Nirmatrelvir (PF-07321332), ein oraler kovalenter 3CL-Protease-Inhibitor von SARS-CoV-2 und Ritonavir, ein Inhibitor der HIV-1- und HIV-2-Protease. In der Kombination soll Ritonavir als Inhibitor von Cytochrom P450 3A und CYP2D6 dazu beitragen den Metabolismus von Nirmatrelvir zu hemmen, so dass die Verabreichung einer niedrigeren Dosis der Substanz ermöglicht wird. Nirmatrelvir bindet an den katalytischen Cysteinrest Cys145 der Coronavirus-Proteasen. In vitro hemmt der Wirkstoff die 3-Chymotrypsin-like Protease (3CLpro). Coronavirus-Proteasen spalten mehrere Stellen im viralen Polyprotein. Durch die Hemmung können Virusbausteine nicht mehr produziert werden und der Virus-Replikationszyklus wird unterbrochen, da die zur erfolgreichen Virusreproduktion benötigten funktionellen Bauteile fehlen.
Gegenanzeigen
Paxlovid darf unter folgenden Gegebenheiten nicht angewendet werden:
- Überempfindlichkeit gegen die Wirkstoffe oder einen der genannten sonstigen Bestandteile des Arzneimittels
- Anwendung von Arzneimitteln mit stark CYP3A-abhängiger Clearance, bei denen eine erhöhte Plasmakonzentration mit schwerwiegenden und/ oder lebensbedrohlichen Reaktionen einhergeht.
- Anwendung von Arzneimittel, die starke CYP3A-Induktoren sind, bei denen signifikant reduzierte PF-07321332/ Ritonavir-Konzentrationen im Plasma mit einem potenziellen Verlust des virologischen Ansprechens und einer möglichen Resistenzbildung einhergehen können.
Darüber hinaus darf Paxlovid nicht unmittelbar nach dem Absetzen eines der folgenden Arzneimittel begonnen werden, da die Wirkung des kürzlich abgesetzten CYP3A‑Induktors verzögert nachlässt:
- α1 -Adrenorezeptor-Antagonist: Alfuzosin
- Analgetika: Pethidin, Piroxicam, Propoxyphen
- Antianginöse Arzneimittel: Ranolazin
- Arzneimittel gegen Krebserkrankungen: Neratinib, Venetoclax
- Antiarrhythmika: Amiodaron, Bepridil, Dronedaron, Encainid, Flecainid, Propafenon, Chinidin
- Antibiotika: Fusidinsäure, Rifampicin
- Antikonvulsiva: Carbamazepin, Phenobarbital, Phenytoin
- Arzneimittel gegen Gicht: Colchicin
- Antihistaminika: Astemizol, Terfenadin
- Antipsychotika: Lurasidon, Pimozid, Clozapin, Quetiapin
- Ergotaminderivate: Dihydroergotamin, Ergometrin, Ergotamin, Methylergometrin
- GI-motilitätsmodifizierende Arzneimittel: Cisaprid
- Pflanzliche Arzneimittel: Johanniskraut (Hypericum perforatum)
- HMG-CoA-Reduktase-Inhibitoren: Lovastatin, Simvastatin
- Inhibitoren des Mikrosomalen Triglycerid-Transferproteins (MTTP): Lomitapid
- PDE-5-Inhibitoren: Avanafil, Sildenafil, Vardenafil
- Sedativa/ Hypnotika: Clorazepat, Diazepam, Estazolam, Flurazepam, oral angewendetes Midazolam und Triazolam
Die aufgeführten Arzneimittel stellen eine Orientierungshilfe dar. Es handelt sich nicht um eine vollständige Liste aller Arzneimittel, die mit Paxlovid kontraindiziert sind.
Nebenwirkungen
Die häufigsten Nebenwirkungen, die während der Behandlung mit Paxlovid alle 12 Stunden über 5 Tage sowie innerhalb von 34 Tagen nach der letzten Dosis gemeldet wurden, waren:
- Geschmacksstörungen (5,6%)
- Diarrhö (3,1%)
- Kopfschmerzen (1,4%)
- Erbrechen (1,1%)
Wechselwirkungen
Folgende Wechselwirkungen müssen bei der Anwendung von Paxlovid beachtet werden.
Studienlage
In einer aktuellen 1:1 randomisierten Studie gegenüber Placebo wurde Paxlovid an fünf aufeinanderfolgenden Tagen alle 12 Stunden oral verabreicht (Mahase, 2021b). Die Studie ergab, dass von den Patienten, die innerhalb von drei Tagen nach Auftreten der Symptome mit Paxlovid behandelt wurden, drei von 339 (0,8%) Teilnehmern bis zum 28. Tag nach der Randomisierung ins Krankenhaus eingeliefert und keine Todesfälle gemeldet wurden. Im Vergleich dazu wurden 7% (27/385) der Patienten, die Placebo erhielten, ins Krankenhaus eingeliefert, wobei sieben Todesfälle gemeldet wurden. Die statistische Signifikanz dieser Ergebnisse wurde als hoch eingeschätzt (p<0,0001).
Bei Patienten, die innerhalb von fünf Tagen nach Auftreten der Symptome behandelt wurden, wurde 1% (6/607) der mit Paxlovid behandelten Personen bis zum 28. Tag ins Krankenhaus eingeliefert, verglichen mit 6,7% (41/612) der Patienten in der Placebogruppe. Bis Tag 28 wurden in der Paxlovid-Gruppe keine Todesfälle gemeldet, im Vergleich zu 10 Todesfällen (1,6%) in der Placebo-Gruppe (Mahase, 2021b).
Wirksamkeit gegenüber Omikron
Nach Angaben von Pfizer zeigen die Ergebnisse aus mehreren in-vitro-Studien, dass die Wirksamkeit des Coronamedikaments Paxlovid (Nirmatrelvir, der aktive Hauptprotease-Inhibitor und Ritonavir) gegen die SARS-CoV-2-Variante Omikron aufrechterhalten bleibe. Der Pharmakonzern erklärt, dass das Präparat in-vitro Plasmakonzentrationen aufrechterhalten konnte, die um ein Vielfaches höher seien als die Menge, die erforderlich wäre, um die Replikation von Omikron in Zellen zu verhindern. Der Konzern möchte diese Ergebnisse nun unter realen Bedingungen überwachen und validieren.
Aufgrund der vielen Mutationen, die Omikron charakterisieren, scheinen einige COVID-19-Antikörpermedikamente wie beispielsweise die Kombinationen aus den Antikörpern Casirivimab und Imdevimab (Ronapreve) sowie aus Etesevimab und Bamlanivimab nicht mehr gegen den Stamm zu wirken. Neben Paxlovid scheint auch das Antikörperpräparat Xevudy (Sotrovimab) seine Wirkung gegenüber der Omikron-Variante beizubehalten.
Empfehlungsgrundlage
Grundlage der Empfehlung bilden Daten einer Studie an COVID-19-Patienten, die zeigen, dass die Behandlung mit Paxlovid Hospitalisierungen oder Todesfälle bei Patienten mit mindestens einer zugrunde liegenden Erkrankung, die sie einem Risiko für schweres COVID-19 aussetzt, signifikant reduzierte. Paxlovid oder Placebo wurden innerhalb von 5 Tagen nach Beginn der COVID-19-Symptome verabreicht. Im Monat nach der Behandlung waren 0,8% (8 von 1.039) der Patienten, die Paxlovid erhielten, länger als 24 Stunden im Krankenhaus, verglichen mit 6,3% (66 von 1.046) der Patienten, die Placebo erhielten. Es gab keine Todesfälle in der Paxlovid-Gruppe und 9 Todesfälle in der Placebo-Gruppe.
Die Mehrheit der Patienten in der Studie war mit der Delta-Variante infiziert. Basierend auf Laborstudien wird erwartet, dass Paxlovid auch gegen Omikron und andere Varianten aktiv ist.
Sicherheitsprofil
Das Sicherheitsprofil von Paxlovid war günstig und die Nebenwirkungen waren im Allgemeinen gering. Es ist jedoch bekannt, dass Ritonavir die Wirkung vieler anderer Arzneimittel beeinflusst, und Warnhinweise und Ratschläge wurden in die Produktinformationen von Paxlovid aufgenommen. Darüber hinaus hat das Unternehmen auf seiner Website ein Tool zur Arzneimittelinteraktion bereitgestellt, auf das über einen QR-Code zugegriffen werden kann, der in den Produktinformationen und auf dem Umkarton enthalten ist. Ein Schreiben wird an die relevanten Organisationen der Angehörigen der Gesundheitsberufe gesendet, um sie weiter an das Problem zu erinnern.
Der CHMP kam zu dem Schluss, dass der Nutzen des Arzneimittels bei der zugelassenen Anwendung gegenüber den Risiken überwiegt, und wird seine Empfehlungen nun an die Europäische Kommission zwecks einer raschen Entscheidung, die in allen EU-Mitgliedstaaten gilt, übermitteln.